גידולי בלוטת יותרת המוח הקדמית (היפופיזה), האדנומות1, הם גידולים שפירים ומהווים כעשרה אחוזים מכלל הגידולים בגולגולת. גידולים שפירים אלה גדלים לאט, מופיעים, במקרים רבים, בגיל צעיר יחסית ומלווים, במרבית המקרים, בתסמונות של עודף הפרשה הורמונלית או תת הפרשה, כתוצאה מפגיעה בהפרשה ההורמונלית מתאי הבלוטה. האדנומות מתחלקות למפרישות הורמונים ולפיכך גורמות לתסמונות קליניות אופייניות ולכאלו שאינן מפרישות או מפרישות הורמון לא פעיל. ניתן בהדמיית האוכף התורכי בעזרת CT או MRI לזהות את האדנומות ולהעריך את גודלן ואת מידת התפשטותן.
פרולקטינומות
הסוג השכיח ביותר מבין האדנומות (כ-40 אחוז) הוא הפרולקטינומות - גידולים של תאים לקטוטרופים מפרישי פרולקטין. גידולים אלה שכיחים הרבה יותר בנשים מאשר בגברים. בנשים מוצאים לרוב מיקרואדנומות (בקוטר פחות מ-10 מ"מ, לעתים האדנומה אף קטנהמ-2 מ"מ ולא ניתן לאתרה), ההסתמנות לרוב בגיל הפוריות (גיל 40-20), רמות הפרולקטין בסרום הן לרוב עשרות עד מאות נ"ג/מ"ל (הנורמה עד 20 נ"ג/מ"ל) וביטויי הפרולקטינומה כוללים שיבוש או הפסקה במחזור החודשי, חוסר פוריות וזליגת חלב מהשד (גלקטוריאה). בגברים, ההסתמנות לרוב מאוחרת יותר (גיל 50-30), הפרולקטינומות הן לרוב מעל 10 מ"מ (מאקרואדנומות), רמות הפרולקטין גבוהות הרבה יותר - מאות ואף אלפי נ"ג/מ"ל (הנורמה בגברים עד גיל 17) וביטוייהן כוללים אימפוטנציה, ירידה בליבידו, חוסר פוריות ולעתים גינקומסטיה ואפילו זליגת חלב במקרים נדירים. אדנומות גדולות וחודרניות (בהדמיית CT או MRI) עלולות להתפשט למעלה, ללחוץ על תצלובת עצבי הראייה ולגרום לפגיעה בראייה. רמות הפרולקטין המוגברות גורמות לדיכוי הגונדוטרופינים ולפיכך לרמות אסטרוגן נמוכות בנשים ולרמות טסטוסטרון נמוכות בגברים. מצב היפוגונדי זה עלול להוביל לאוסטיאופורוזיס לאחר שנים, ובגברים גם לאנמיה מתונה.
הטיפול בפרולקטינומות, הן בנשים והן בגברים, הוא תרופתי בעיקר. מאז שנכנס בשנות ה-70 הברומוקריפטין לשימוש בנשים עם פרולקטינומות, הפך הטיפול התרופתי לגישה הטיפולית המומלצת בפרולקטינומות2. הברומוקריפטין (בארץ מוכר כ-Parilac, Parlodel) הוא תכשיר אגוניסטי לדופמין שמופרש מההפותלמוס ומוכר כמדכא של הפרולקטין בעקבות התקשרותו לרצפטור דופמין D2 שביותרת המוח. מתן יומי של ברומוקריפטין (7.5-2.5 מ"ג) ידכא ב-70אחוז מהמטופלים והמטופלות את הפרולקטין לנורמה, יחזיר את התפקוד המיני לנורמה, ישיב את הביוץ התקין, יפסיק את הגלקטוריאה ויגרום להצטמקות האדנומות ברוב המטופלים.
בנשים, טיפול יעיל יאפשר במרבית המקרים הריון, אז ניתן לרוב להפסיק את הטיפול התרופתי. בגברים, הצטמקות האדנומות הגדולות מלווה בהקלה מהירה של הלחץ על עצבי הראייה ובשיפור מהיר בראייה במקרים אלה. הטיפול בתרופה מלווה לעתים בתופעות לוואי של סחרחורת או בחילה, אך אלו לרוב תופעות חולפות. בשנות ה-90 נכנס לשימוש תכשיר חדש מסוג אגוניסט לדופמין, ה-Cabergoline, המוכר בשמו המסחרי Dostinex או Cabotrim. לתכשיר זה מספר יתרונות על פני הברומוקריפטין כמו מתן פעם או פעמיים בשבוע (סך הכל 2-0.5 מ"ג לשבוע), פחות תופעות לוואי ובעיקר יעילות גבוהה יותר עם השגת דיכוי של הפרולקטין בכ-90 אחוז מהמטופלים, השבת התפקוד השחלתי התקין, החזרת התפקוד המיני והצטמקות האדנומות
במרבית המקרים4,3. התרופה נמצאה בטוחה לשימוש, כמו הברומוקריפטין ונמצאה יעילה גם בשימוש במינונים גבוהים (7-3.5 מ"ג לשבוע) לטיפול במאקרואדנומות ענקיות ומפושטות בגברים5. במינונים גבוהים אלה יש לעקוב אחרי החולים בעזרת אקוקרדיוגרפיה של הלב, כיוון שדווח בחולי פרקינסון המטופלים ב-Cabergoline במינון גבוה (4 מ"ג ליום ויותר) על פגיעה אפשרית במסתמי הלב. כיוון שגם הברומוקריפטין וגם ה-Cabergoline ניתנים לנשים לקראת ההריון, הנושא של בטיחות התרופות לעובר נדון רבות. הניסיון שהצטבר עם השנים בנשים שהרו תוך חשיפה לשני התכשירים הוא גדול ומאפשר לקבוע שאין שום עדות לנזק טרטוגני בשימוש בהם6.
הטיפול התרופתי בפרולקטינומות עשוי להימשך שנים. ניתן להפחית לאחר שנתיים-שלוש את המינון בהדרגה, ובמידה שרמת הפרולקטין נשארת תקינה והדמיית האוכף התורכי מראה הצטמקות ואף היעלמות האדנומה, ניתן לנסות להפסיק את הטיפול7. ברוב המקרים שבהם האדנומה לא נראית, ההיפרפרולקטינמיה לא תישנה.
ניתוחים בגישה טראנס-ספנואידלית להסרת פרולקטינומות אינם מומלצים, כיוון שהסיכוי לריפוי ארוך טווח בניתוח למיקרואדנומות הוא כ-50 אחוז בלבד וכ-20 אחוז במאקרואדנומות8. ניתוח מיועד רק לחולות ולחולים עמידים לטיפול בתכשירים הקיימים, כאלה שאינם סובלים הטיפול, חולים עם אדנומות גדולות הגורמות לנזק לראייה ונדרשת דקומפרסיה מיידית להצלת הראייה, ואדנומות שמסתמנות עם Apoplexy (נמק פתאומי של אדנומה גדולה, המתבטא בכאב ראש, הפרעת ראייה חדשה, בחילות והקאות והתפתחות תת פעילות בהפרשת הורמוני ההיפופיזה) שמסכנת את חיי החולה. טיפול בקרינה לאדנומות מפרישות פרולקטין נוסה בהצלחה מועטת בלבד, כיוון שאדנומות אלו אינן רגישות לקרינה.
אקרומגליה
מחלת האקרומגליה נגרמת על ידי הפרשה מוגברת של הורמון גדילה (ה"ג) מאדנומה ביותרת המוח שמכילה תאים סומטטוטרופים9. לרוב מדובר במאקרואדנומות שמהוות כעשרה אחוזים עד 15 אחוז מכלל גידולי יותרת המוח. שכיחות המחלה בגברים ונשים דומה והיא מתגלית לרוב בגילאי 50-30. בילדים היא תסתמן בגדילה מוגזמת לגובה (ענקות) ובצעירים סביב גיל 20 אופייני למצוא אדנומות ענקיות. ההפרשה המוגברת של ה"ג יוצרת גירוי מתמיד בתאי הכבד לייצור עודף של ההורמון IGF-1, האחראי בסופו של דבר לרוב תסמיני המחלה. אלה כוללים הגדלת כפות הידיים והרגליים, הגדלת הלשון, הגדלת איברים פנימיים, מראה אופייני גס של הפנים עם עיבוי האף והתבלטות הלסת התחתונה, התעבות הרקמות הרכות, הזעת יתר, כאבי פרקים, יתר לחץ דם, עלייה ברמות הסוכר, נחירות, הפסקות נשימה ועוד. כרבע מהאדנומות שמפרישות ה"ג מפרישות גם פרולקטין. חלק גדול מהמאקרואדנומות הגדולות מתפשט מעלה ודוחק את תצלובת עצבי הראייה, וכך הן עלולות לגרום לנזק האופייני של היצרות שדות הראייה הצדדיים (Bitemporal Hemianopsia). אבחון המחלה נעשה באמצעות מדידת רמות מוגברות של ה"ג ו-IGF-1 בסרום. הדמיית האוכף ב-MRI תראה את גודל וגבולות האדנומה.
הטיפול המומלץ באקרומגליה הוא הסרה כירורגית של האדנומה בניתוח בגישה טרנס-ספנואידלית. ניתוח כזה, המבוצע על ידי מנתח מנוסה, יגרום לריפוי בכ60-50- אחוז מהמנותחים10, אך ברוב המקרים שבהם מדובר בגידול מפושט, רמות ה"ג וה-IGF-1 יישארו מוגברות ויידרש טיפול תרופתי קבוע. גם במקרים שבהם לא הושג ריפוי, לניתוח תפקיד בהסרה של רקמת גידול המאיימת על תצלובת עצבי הראייה וכן בהגדלת הסבירות להצלחת טיפול תרופתי בהמשך.
הטיפול התרופתי באקרומגליה מבוסס ב-20 השנים האחרונות על אנלוגים של סומטוסטטין. סומטוסטטין הוא פפטיד בן 14 חומצות אמינו שמופרש באופן טבעי מההפותלמוס ובהגיעו ליותרת המוח מדכא את רמת ה"ג באופן יעיל באמצעות התקשרותו לקולטנים שלו (חמישה במספר) על פני התאים הסומטטוטרופים. קיימים שני תכשירים מסחריים כאלה - Octreotide Sandostatin (Novartis) וכן Lanreotide, Somatuline (Ipsen) שנקשרים בעיקר לקולטנים מס' 2 ו-5 ובטיפול ארוך טווח מדכאים הפרשת ה"ג ו-IGF-1 בכ-60 אחוז ממקרי האקרומגליה. טיפול זה, הניתן בזריקות ארוכות טווח
(Sandostatin LAR במינון 30-10 מ"ג; Somatuline Autogel במינון של 120-60 מ"ג כל ארבעה שבועות) מפחית בהדרגה את הסממנים האופייניים לאקרומגליה ומסוגל בחלק גדול מהחולים להקטין את גודל האדנומה13,12,11. לטיפול זה תופעות לוואי שכוללות שלשולים, כאבי בטן, אבני כיס מרה וגם היפרגליקמיה או היפוגליקמיה כתוצאה מיכולת הסומטוסטטין לדכא הפרשת אינסולין וגלוקגון בלבלב. טיפול באגוניסטים של דופמין (בעקר Cabergoline) נוסה בהצלחה מסוימת בחולים עם גדולים מפרישי ה"ג, בעקר באלה עם אדנומות שמפרישות גם פרולקטין, ונמצא יעיל בדיכוי ה"ג ו-IGF-1 בלא יותר מעשרה אחוזים עד 20 אחוז מהמטופלים.
כ-40 אחוז מהמטופלים באקרומגליה בתרופות הסומטוסטטין אינם משיגים רמיסיה הורמונלית ולכן זקוקים לטיפול אחר. בעשר השנים האחרונות פותח תכשיר מסוג חדש, ה-Pegvisomant (Somavert; Pfizer) שהוא אנלוג של ה"ג המבוסס על מולקולת ה"ג שעברה שינויים מבניים מסוימים באמצעות הנדסה גנטית. תכשיר זה חוסם את הקולטן לה"ג ומונע קשירת ה"ג לתאים ולכן מפחית מאוד את ייצור IGF-1 בכבד. ה-Pegvisomant נמצא בעולם מספר שנים בשימוש בחולי אקרומגליה, ובארץ נרשם ונכלל בסל התרופות משנת 2008 כטיפול תרופתי קו שני לחולי אקרומגליה. התרופה ניתנת כזריקה תת עורית פעם ביום במינון של 20-10 מ"ג ומורידה את רמת ה-IGF-1 במהירות לנורמה בכ90- אחוז מהמטופלים15,14. סממני המחלה פוחתים במקביל לירידת רמת ההורמון. בניגוד לתכשירי הסומטוסטטין, רמת ה"ג אינה מדוכאת (אלא עולה פי שניים-שלושה) ומסת הגידול אינה מושפעת מהטיפול. רמות הסוכר לרוב יורדות.
לאחרונה נבדק תכשיר חדש מקבוצת האנלוגים לסומטוסטטין, ה-Pasireotide (SOM-230; Novartis) שנקשר לקולטנים 1, 2, 3 ו5- לסומטוסטטין16 ועשוי להיות יעיל בדיכוי ה"ג ו-IGF-1 בחלק מהחולים שלא מגיבים לאנלוגים הקיימים17. תכשיר זה נבדק בהצלחה במחקר פאזה 2, וכעת במחקר פאזה 3 ניתן בזריקה כל ארבעה שבועות למאות חולים עם אקרומגליה בהשוואה לזריקות סנדוסטטין, לפני מתן אישור ה-FDA לרישום התרופה.
טיפול ממוקד בקרינה לגידול יכול להוריד רמות ה"ג ו-IGF-1 לנורמה בכ-50אחוז מהמטופלים. במיוחד יעילה הקרינה החד פעמית הסטראוטקטית בשיטת ה-Radiosurgery שמיועדת לשארית גידול קטנה וממוקמת שאינה צמודה לעצבי הראייה. במקרים אחרים ניתן להשתמש בסדרת הקרנות, ה-FSR. בשתי צורותיה עוברות שנתיים עד שלוש שנים להשגת רמיסיה בעזרת הקרינה הממוקדת, והדבר עלול להיות מלווה בהתפתחות תת פעילות של הורמוני יותרת המוח האחרים.
מחלת קושינג
אדנומות המכילות תאים קורטיקוטרופים ומפרישות את הורמון ACTH גורמות למחלת קושינג. אלו מהוות כעשרה אחוזים מכלל האדנומות בהיפופיזה, לרוב הן קטנות מ-10מ"מ ושכיחות יותר בנשים. לחולים מראה אופייני בפנים, השמנה מרכזית, עודף שומן באזור העל-בריחי, השמנה באזור העורף (Buffalo hump), סימני מתיחה כחולים-ורודים בשיפולי הבטן ובבתי השחי, בצקות ברגליים, אוסטיאופורוזיס, חולשת שרירים, ובנשים, נטייה לשיעור יתר, אקנה והפסקת המחזור. כמו כן עליית לחץ דם, התפתחות סוכרת, שינויי מצב רוח עד דיכאון. האבחון מבוסס על הוכחה של הפרשת קורטיזול מוגברת באיסוף שתן, חוסר דיכוי הקורטיזול בדם לאחר מתן דקסאמטזון ורמת ACTH מוגברת. כיון שמדובר לרוב במיקרואדנומות, לא ניתן בחלק מהמקרים להדגים את הגדול ב-MRI. הפרשת ACTH אקטופית מגדולים בחזה (Carcinoid או גידולים ממאירים) עלולה לגרום לתסמונת דומה ולהקשות באבחון ובטיפול.
הטיפול המומלץ למחלת קושינג הוא הסרת כירורגית של הגידול ביותרת המוח בגישה טרנס-ספנואידלית. בידיים מיומנות, הסיכוי לריפוי הוא כ-75 אחוז, בעיקר במקרים של מיקרואדנומות18. במידה שהניתוח נכשל וקיימת הוכחה ברורה שהמקור הוא היפופיזרי (על פי מדידת ACTH בזמן צנתור של ה-Petrosal Sinuses Inferior) ניתן לשקול ניתוח חוזר, או הקרנה ממוקדת לכיוון האוכף התורכי. בעבר היה מקובל לבצע אף כריתה דו-צדדית של האדרנלים, שסיכנה את החולים בהתפתחות תסמונת Nelson (הגדלה בלתי מרוסנת של שרידי האדנומה, עם הפרשת ACTH מוגברת מאוד) וחייבה טיפול הורמונלי תחליפי קבוע.
קיימים מספר תכשירים עם יכולת לדיכוי ייצור הקורטיזול באדרנל שאפשר לתת לחולים עם מחלת קושינג פעילה לאחר כשלון ניתוחי ועד להשגת ההשפעה המיטיבה של הקרינה19. תכשירים אלה כוללים את ה-Ketoconazole (Nizoral; תכשיר אנטי-פטרייתי), Mitotane (o,p'-DDD, שמשמש לטיפול ב-(Adrenal Carcinoma, ו-Aminoglutethimide (תכשיר כנגד פרכוסים).
לאחרונה מתרבות העדויות שכמה מהאדנומות שמפרישות ACTH מבטאות קולטנים לדופמין, וטיפול באגוניסט לדופמין, Cabergoline, מסוגל לדכא בעד שליש מהמקרים הפרשת קורטיזול בצורה משמעותית20. נמצא שהתאים הקורטיקוטרופיים באדם מבטאים היטב גם את הקולטן מס' 5 לסומטוסטטין.
ה-Pasireotide (SOM-230), שנמצא יעיל לדיכוי ה"ג באקרומגליה ונקשר היטב לקולטן מספר 5, נבדק כעת במחקר פאזה 3 גם בחולים עם מחלת קושינג לאחר שנמצא יעיל בדיכוי הפרשת קורטיזול בחלק מהחולים שטופלו בו לזמן קצר במסגרת מחקר פאזה212. במידה שהתרופה תימצא יעילה, הרי שלראשונה תהיה אפשרות לטפל במחלת קושינג בתכשיר שישפיע ישירות לדיכוי הפרשת ACTH מהאדנומה בהיפופיזה וללא החשש מהתפתחות תסמונת Nelson.
אדנומות מפרישות TSH
אדנומות אלו, המורכבות מתאים טירוטרופיים, הן נדירות מאוד, מהוות פחות מאחוז אחד מכלל גדולי יותרת המוח ומסתמנות עם פעילות יתר של בלוטת התריס כתוצאה מהפרשה מוגברת מתמדת של TSH (רמות ה-TSH הן תקינות או מוגברות, למרות רמה מוגברת של הורמוני בלוטת התריס). רובן הן מאקרו אדנומות ולכן ניתוח להסרתן נכשל במקרים רבים והחולים נשארים עם רמות הורמוני תריס מוגברות. בחלק מהמקרים יש גם הפרשה של ה"ג או פרולקטין מהאדנומה. טיפול בתכשירים מדכאי בלוטת התריס (PTU או (Mercaptizol אינו מומלץ, כיוון שהם לא מדכאים הפרשת TSH. טיפול תרופתי קבוע באנלוגים של סומטוסטטין (Octreotide או Lanreotide) נמצא יעיל מאוד בדיכוי הפרשת ה-TSH וכתוצאה מכך רוב החולים חוזרים להיות 23,22Euthyroid, לרוב במינון נמוך מזה הנדרש בטיפול באקרומגליה.
אדנומות לא תפקודיות
כ-35 אחוז מהאדנומות ביותרת המוח מתגלות כלא מפרישות הורמון פעיל ולכן לא גורמות לאחת מהתסמונות שתוארו. לרוב מדובר במאקרו אדנומות שמורכבות מתאים גונדוטרופים, שמפרישים את תת היחידות של הגונדוטרופינים (α-subunits, FSH-β, LH-β). כיוון שפפטידים אלה לא פעילים, ההסתמנות של אדנומות אלו תלויה בלחץ שהן יוצרות על סביבתן (פגיעה בראייה כתוצאה מלחץ על עצבי הראייה, פגיעה בהפרשה ההורמונלית התקינה של יותרת המוח). הטיפול המומלץ באדנומות גדולות הקרובות לתצלובת הראייה הוא ניתוח להסרת האדנומה, כדי להקל הלחץ על עצבי הראייה. לעתים יש גדילה מחודשת של האדנומה שנותחה. ניתן אז להציע טיפול בקרינה ממוקדת לשארית הגידול. לא קיים היום טיפול תרופתי מאושר לאדנומות לא מפרישות. ניתן לנסות טיפול ב-Cabergoline כדי למנוע גדילה מחודשת של אדנומה שהוסרה חלקית בניתוח24, למרות שחסרות הוכחות חד משמעותיות שטיפול זה יעיל. לאחרונה מצטברות עדויות מנסיונות בתרביות תאים של אדנומות אנושיות לא מפרישות ש-Pasireotide מסוגל לדכא חיותם של תאים אלה25. גם דופסטטין (פיתוח של חברת Ipsen), מולקולה כימרית המאחדת מאפיינים של דופמין וסומטוסטטין ומסוגלת להקשר לקולטן D2 ולקולטנים לסומטוסטטין, נמצאה יעילה בעיכוב גדילה של תאי אדנומות לא תפקודיות בתרביות תאים26.
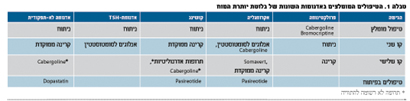
לסיכום, הטיפול באדנומות של יותרת המוח תלוי בסוג האדנומה. בפרולקטינומות, הטיפול המומלץ הוא תרופתי, ורק במקרים של עמידות או אי סבילות לטיפול באגוניסטים לדופמין, יש להפנות החולה לניתוח. באקרומגליה, מחלת קושינג, אדנומות לא תפקודיות וכאלו שמפרישות TSH, הטיפול המומלץ הוא ניתוח בגישה טרנס-ספונאידלית להסרה של מסת הגידול. במקרים שבהם ההפרשה העודפת (ה"ג, קורטיזול, הורמוני בלוטת התריס - תלוי בסוג האדנומה) נמשכת, יש להציע למטופל טיפול תרופתי קבוע באנלוגים לסומטוסטטין (באקרומגליה או אדנומות TSH), או בקרינה (מחלת קושינג). באקרומגליה ניתן לטפל גם באנטגוניסט לה"ג במידה שסומטוסטטין נכשל. בקושינג ניתן לתת תכשירים מדכאי ייצור קורטיזול באדרנל עד להשגת האפקט של הקרינה. בשנים הקרובות צפויים להיכנס לשימוש תרופות חדשות לאקרומגליה ומחלת קושינג ובעתיד אולי אף לאדנומות לא מפרישות.
ד"ר אילן שמעון, מנהל המכון לאנדוקרינולוגיה, סוכרת ומטבוליזם, מרכז רפואי רבין, בית החולים בילינסון; הפקולטה לרפואה ע"ש סאקלר, אוניברסיטת תל אביב |