|
המהלך הטבעי של זיהום כרוני ב- HBV מתאפיין בארבעה שלבים:
1. שלב מוקדם של טולראנס אימונולוגי - רמות גבוהות של HBVDNA HBeAg חיובי ורמות תקינות של ALT בסרום. מופיע בחולים שמחלתם נרכשה בלידה או בילדות.
2. הפטיטיס כרונית HBeAg חיובי - רמות גבוהות של HBVDNA (IU/mL< (20,000 ושל ALT בסרום.
3. נשא בלתי פעיל - מתפתח לאחר סרוקונברסיה ספונטנית של ,HBeAg רמות נמוכות/שליליות של HBVDNA ורמות תקינות של ALT בסרום. הפרוגנוזה טובה.
4. הפטיטיס כרונית HBeAg שלילי (pre-core mutant) - נובע ממוטציה ספציפית ב-HBV גנום שאיננה מאפשרת ייצור של HBeAg בנוכחות רפליקציה פעילה של הנגיף2.
ה-End-points שאותן רצוי להשיג במתן טיפול אנטי-וירלי, בחולים עם HBeAg חיובי: סרוקונברסיה של ה-e אנטיגן, נורמליזציה של אנזימי הכבד, דיכוי מקסימלי (רצוי להגיע לרמות בלתי מדידות) של ה-HBVDNA ושיפור היסטולוגי.
בחולים עם HBeAg שלילי: נורמליזציה של אנזימי הכבד, דיכוי מקסימלי של ה-HBVDNA ושיפור היסטולוגי. המטרה העיקרית של הטיפול היא למנוע התפתחות של שחמת וסיבוכיה והתפתחות של הפטוצלולר קרצינומה.
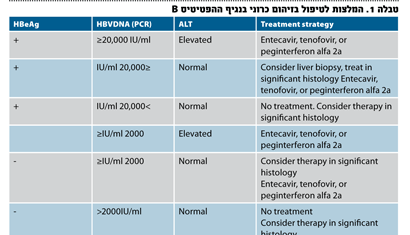
ההמלצות של ה-ASSLD (American Association for the Study of Liver Disease) לטיפול בזיהום כרוני ב-HBV כללו עד כה רמה של HBVDNA >IU/mL
20,000 (או copies/ml 100,000) ורמות של ALT הגבוהות פי שניים מהנורמה2. אולם, ממחקרים שפורסמו לאחרונה מתברר שרמות הנמוכות מסף מוסכם זה לטיפול כרוכות בהתקדמות המחלה לשחמת, באי-ספיקה כבדית ובסרטן ראשוני של הכבד. מתברר כי חולים עם רמת ALT הגבוהה פי אחד או שניים מהנורמה היו בסיכון הגבוה ביותר לפתח שחמת וסיבוכיה והפטוצלולר קרצינומה3. כמו כן הוכח באותן עבודות, שרמות HBVDNA בסרום הגבוהות מ-IU/ml 2,000 קשורות בסיכון של פי 6.2 לפתח שחמת ופי 2.4 לפתח הפטוצלולר קרצינומה4.
לעומת זאת, דיכוי ממושך ויעיל של ה-HBVDNA הקטין את הסיכון לפתח שחמת וקרצינומה הפטוצלולרית. נמצא שאצל 70 אחוז מהחולים שפיתחו שחמת והפטוצלולר קרצינומה ה-e אנטיגן שלילי, כך שלמרות הסרוקונברסיה של ה-e אנטיגן, המחלה יכולה להתקדם1.
לאור האמור לעיל, הנחיות ה-AASLD לטיפול בזיהום כרוני בנגיף ההפטיטיס B השתנו כך שכיום, פרט לסרוקונברסיה של ה-e אנטיגן, המטרה העיקרית החשובה יותר בטיפול היא דיכוי מתמשך של ה-HBVDNA לרמות נמוכות ביותר, עם העדפה להגיע לרמות שלא ניתן למדוד אותן ב-PCR (לא ניתן להגיע עם הטיפול האנטי-וירלי הקיים לאירדיקציה מלאה של הנגיף!).
בחולים עםHBeAg חיובי ניתן לטפל ברמה של HBVDNA IU/mL< 20,000 גם כאשר רמת ה-ALT בתחום הנורמה או כאשר היא מוגברת מינימלית. בחולים עם HBeAg שלילי ועדות בביופסיית כבד לדלקת מדרגה בינונית עד קשה, או פיברוזיס משמעותית, יש לטפל כאשר רמת ה-HBVDNA בסרום היא מעל IU/mL 20,00 ורמת ה-ALT בתחום הנורמה או מוגברת מינימלית5,2 (טבלה 1).
ה- FDA אישר עד היום שבע תרופות לטיפול בזיהום כרוני ב-HBV והן נחלקות לשתי קבוצות עיקריות5,2: הראשונה, אינטרפרון סטנדרטי (interferon alfa-2b)
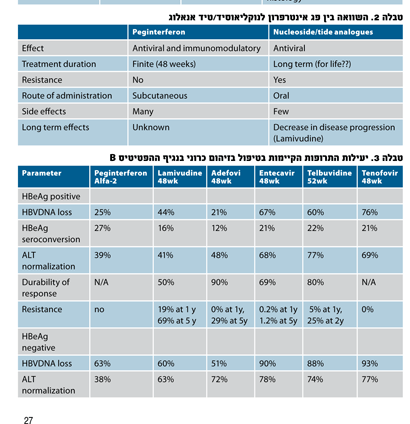
וה-pegylated interferon alfa-2a. לאינטרפרון אפקט אנטי-ויראלי ואימונומודולטורי, משך הטיפול קצוב ואיננו כרוך בהתפתחות של זנים עמידים. אך האינטרפרון ניתן בזריקה ויש לו תופעות לוואי מרובות. הפגאינטרפרון, הניתן בזריקה חד-שבועית, מחליף את האינטרפרון הסטנדרטי. אין עדיין מספיק מידע על ההשפעות הארוכות טווח של הפג אינטרפרון על ההתפתחות של שחמת והפטוצלולר קרצינומה.
קבוצת התרופות השנייה היא נוקליאוסיד/טיד אנאלוג, הניתנות דרך הפה: ,tenofovir lamivudine ,adefovir ,entecavir ו-telbivudine לכולם פעילות אנטי-וירלית פוטנטית (הפוטנטיות ביותר הן האנטקביר, טנופוביר והטלבווידין, ללמיבודין פעילות בינונית ולאדפוביר פעילות נמוכה). תרופות אלו מדכאות את שכפול הנגיף על ידי עיכוב בפעילות של ה-reverse-transcriptase ושל ה-DNA polymerase. אין להם תופעות לוואי קשות, הן נסבלות היטב אך הטיפול בתרופות אלו כרוך בהתפתחות של זנים עמידים ולאורך זמן טיפול זה יקר. המחקרים מראים שטיפול ממושך בלמובידין (שלוש שנים) הקטין באופן משמעותי סטטיסטית את התקדמות המחלה (Child-Pugh score), אי ספיקה כבדית או התפתחות של סרטן ראשוני של הכבד6) (טבלה 2).
יש לציין שמשרד הבריאות בארץ אישר ב-2009 את הכנסת (
Sebivo)* ,telbivudine
entecavir *(Baraclude) לסל התרופות, זאת בנוסף על האישור הקיים כבר עבור התרופות
*alfa-2a Peginterferon, *(adefovir (Hepsera,
*(lamivudine (Zeffix.
העלייה במספר התרופות המאושרות לטיפול וההתפתחות של זנים עמידים גורמות לכך שהחלטה על מתן טיפול הופכת להיות מורכבת ומתעוררות שאלות כגון מתי להתחיל בטיפול, באיזו תרופה יש לבחור כקו ראשון ובאיזו כקו שני והאם יש צורך לשלב תרופות.
יעילותו של הלמיבודין כנגד HBV אמנם הוכחה, אך היא בעלת פרופיל עמידות גבוה ביותר (27 אחוז עמידות בשנה הראשונה ו-69 אחוז כעבור חמש שנים)7. החל משנת 2007, ה-AASLD איננו ממליץ על למיבודין כקו ראשון לטיפול בחולים עם זיהום כרוני ב-HBV. לאדפוביר יש פרופיל עמידות בינוני, אפס אחוזים בשנה הראשונה ו-29 אחוז כעבור חמש שנים. לאחר שנה של טיפול באדפוביר, ה-HBVDNA בסרום הופך להיות שלילי אצל 21 אחוז מהחולים עם HBeAg חיובי ואצל 51 אחוז עם HBeAg שלילי8 (טבלה 3).
היות שלאדפוביר פעילות אנטי-וירלית חלשה, הוא לא ניתן בחולים שיש צורך בדיכוי וירלי מהיר כמו בחולים עם הפטיטיס קשה או חולים צירוטיים באי ספיקה. תיתכן פגיעה כלייתית בשלושה אחוזים מהחולים. הטנופוביר היא תרופה מבטיחה ביותר. היא דומה במבנה לאדפוביר אך היא פוטנטית הרבה יותר מהאדפוביר ומביאה לדיכוי משמעותי יותר של ה-.HBVDNA אצל 93 אחוז מהחולים עם HBeAg שלילי ו-76 אחוז עם HBeAg חיובי שטופלו בטנופוביר, ה-HBVDNA היה שלילי9 (טבלה 3). עד היום לא זוהו זנים העמידים לטנופוביר ויש פחות פגיעה כלייתית מאשר האדפוביר.
אנטקביר הוא בעל פעילות אנטי-וירלית חזקה ביותר, יש לו פרופיל עמידות הנמוך ביותר (high genetic barrier), 1.2 אחוזים כעבור ארבע שנים. לאחר שנה, ה-HBVDNA בסרום הופך להיות שלילי אצל 67 אחוז מהחולים עם HBeAg חיובי ואצל 90 אחוז עם HBeAg שלילי10 (טבלה 3).
טלבווידין היא תרופה בעלת פעילות אנטי-ויראלית חזקה. שנה לאחר טיפול בה, ה-HBVDNA הופך להיות שלילי אצל 60 אחוז מהחולים עם HBeAg חיובי ואצל 88 אחוז עם HBeAg שלילי11 (טבלה 3). 4.5 אחוזים מפתחים עמידות כעבור שנה ו-21.6 אחוז כעבור שנתיים אצל חולים עם HBeAg חיובי ו-8.6 אחוזים אצל חולים עם HBeAg שלילי. דיכוי מוקדם, משמעותי ומתמשך של HBVDNA בסרום מנבא תגובה וירולוגית מתמשכת. רמה של HBVDNA בסרום מתחת ל-300copies/mL, בשבוע 24 לטיפול בטלבווידין, היה כרוך באחוזים גבוהים של תגובה וירולוגית מתמשכת בחולים עם HBeAg חיובי, 82 אחוז12.
כמו כן, בחולים שה-HBVDNA היה שלילי בשבוע 24 לטיפול, שכיחות העמידות הייתה נמוכה הרבה יותר מאלה שאצלם ה-HBVDNA היה חיובי והגיע רק לארבעה אחוזים ב-HBeAg חיובי ושני אחוזים בחולים ב-HBeAg שלילי12.
ה-pegylated interferon alfa-2a ניתן לתקופה של 48 שבועות. עם הטיפול, ה-HBVDNA הופך להיות שלילי אצל 25 אחוז מהחולים עם HBeAg חיובי ואצל 63 אחוז עם HBeAg שלילי13 (טבלה 3). העבודות מראות יעילות טובה יותר של pegylatedinterferon בחולים עם רמות ALT גבוהות (פי חמישה מהנורמה) ורמות של HBVDNA נמוכות יחסית (<copies/ml 109) ובגנוטיפ A ו-B (טבלה 3).
על פי המלצות ה- AASLD, פגאינטרפרון, אנטקביר וטנופוביר יכולות לשמש כקו ראשון לטיפול בזיהום כרוני בנגיף ההפטיטיס B51,2 וניתן להשתמש בטלבווידין כקו ראשון באותם חולים שאצלם מושג דיכוי מלא של ה-HBVDNA בשבוע 24 לטיפול. משך הטיפול המומלץ במתן של נוקליאוטיד/סיד אנאלוג בחולים עם HBeAg חיובי הוא לפחות שישה חודשים לאחר סרוקונברסיה של ה-HBeAg, ובחולים עם HBeAg שלילי לאחר היעלמות של ה-HBsAg, משמעות ההמלצה היא טיפול ארוך טווח (ייתכן לכל החיים)5,2,1. בחולים עם שחמת ואי ספיקה ולמועמדים להשתלת כבד, יש צורך בטיפול לכל החיים. אם אין תגובה לטיפול באינטרפרון, יש לשקול טיפול בנוקליאוסיד/טיד אנאלוג. בניגוד לאינטרפרון, בחולים עם שחמת מתקדמת ובחולים עם אי ספיקת כבד, הטיפול בנוקליאוסיד/טיד אנאלוג יעיל ובטוח ואף יכול למנוע השתלת כבד.
ההגבלה העיקרית הקיימת על מתן טיפול ארוך טווח בנוקליאוסיד/טיד אנאלוג היא ההתפתחות של זנים עמידים. עמידות וירלית יכולה לגרום (בעיקר אצל חולים שחמתיים) לאי ספיקה כבדית ומוות15-14. מבין הנוקליאוסיד/טיד אנאלוגס הנמצאים בשימוש, ללמובידין וטלבווידין פרופיל עמידות גבוה ועל כן הן נחשבות לתרופות עם
Low genetic barrier. לעומת זאת, לאנטקביר ולטנופוביר פרופיל עמידות נמוך ועל כן הן נחשבות לתרופות עם High genetic barrier. במתן של תרופה הניתנת דרך הפה, יש לבחור בתרופה הפוטנטית ביותר ועם פרופיל העמידות הנמוך15-14. במצבים שבהם התפתחה עמידות לתרופה, החלפת התרופה תגרום להתפתחות של זנים העמידים למספר תרופות. לעומת זאת, תוספת של תרופה שאין לה cross resistance עם התרופה העמידה תמנע מצב של התפתחות זנים העמידים למספר תרופות.
השימוש הנרחב בלמיבודין בשבע-שמונה השנים האחרונות הביא לעלייה ניכרת במספר החולים עם זן מוטנטי של ה-HBV העמיד ללמיבודין. לאדפוביר ולטנופוביר יש פעילות אנטי-וירלית כנגד כל הסוגים של המוטנטים העמידים ללמיבודין ויש תועלת גבוהה יותר בתוספת של אדפוביר/טנופוביר בשילוב עם למיבודין בחולים עם הזן המוטנטי לעומת החלפת התרופה15-14.
לסיכום, שתי שאלות עומדות כרגע על הפרק. האחת, תוספת של תרופה שנייה "על פי דרישה". כלומר, להתחיל טיפול עם תרופה שיש לה
high genetic barrier ולהוסיף תרופה שנייה עם cross resistance שונה כעבור תשעה חודשים. השנייה, להתחיל טיפול מיידי בשילוב של שתי תרופות שאין להן cross resistance. עם זאת יש לזכור כי עדיין לא ידוע איזה שילוב הוא האופטימלי, מהי התועלת-עלות של מתן שילוב של תרופות de novo או מתן של תרופה אחת שיש לה high genetic barrier לעומת התפתחות של עמידות.
פרופ' זין בו ארי, מנהלת יחידה במכון הכבד, המרכז הרפואי רבין, בית החולים בילינסון, פרפוסור לפנימית בבית הספר לרפואה של אוניברסיטת תל אביב |