|
סטפילוקוקוס אאוראוס (Staphylococcus Aureus) ידוע כפתוגן עיקרי בבני אדם מזה מאות שנים וגורם לתחלואה ולתמותה משמעותיות, למרות התקדמות עצומה במדע הרפואה. סטפ. אאוראוס גורם למגוון רחב של זיהומים בקהילה ובמוסדות בריאות, החל מזיהומי עור קלים וכלה בזיהומים מסכני חיים כגון אנדוקרדיטיס, אוסטאומיאליטיס, דלקת ריאות, זיהומים קשים בפצע ניתוח, זיהומים בזרם הדם הקשורים לצנתרים תוך ורידיים מרכזיים ועוד. זיהומים הנגרמים על ידי סטפ. אאוראוס עולים בשכיחותם ובמורכבותם, בצורה אירונית, כתוצאה מהתקדמות הרפואה המודרנית ומיכולתו המופלאה של חיידק זה להסתגל לשינויים בסביבה.
Methicillin- resistant Staphylococcus aureus) MRSA) הופיע לראשונה ב-1960 והפך מאז לאחד הגורמים העיקריים לזיהומים במוסדות בריאות ולאחרונה גם בקהילה. עמידות של MRSA לתכשירי אנטיביוטיקה רבים הגבילה את אפשרויות הטיפול בו ו-וונקומיצין הפכה לתרופת הבחירה לטיפול בזיהומים עם MRSA. למרבה הדאגה, דווח לאחרונה על הופעה של זנים עמידים גם לוונקומיצין (VRSA) כתוצאה מרכישה של הגן van A. תופעה זו מהווה איום בריאותי רציני בבתי חולים ובקהילה.
MRSA - בסיס מולקולרי
המנגנון המולקולרי של העמידות למטיצילין הוא אינטגרציה של אלמנט גנטי: SCCmec אל תוך הגנום של סטפ אאוראוס רגיש למטיצילין (MSSA).
SCCmec הוא אלמנט גנטי מובילי, המכיל בתוכו את הגן .mecA גן זה מקודד את החלבון Penicillin binding protein 2A (PBP2A) אשר מאופיין באפיניות נמוכה לפניצילין.
כתוצאה ממנגנון עמידות זה נוצרת עמידות צולבת לכל קבוצות האנטיביוטיקה ממשפחת ה-beta-lactam. בנוסף לעמידות ל-SCCmec ,beta-lactam מכיל בתוכו גנים נוספים לעמידות לקבוצות אנטיביוטיקה אחרות, כגון אריתרומיצין, טטרהציקלין.
תהליך האינטגרציה של האלמנט הגנטי, ה-SCCmec, התרחש מספר מוגבל של פעמים במהלך ההיסטוריה של יצירת MRSA. ככל הנראה, עקב גודלו של האלמנט המקשה על העברתו.
בבדיקה מולקולרית על ידי PCR, נמצא כי רוב זני ה-MRSA הגורמים לתחלואה במוסדות בריאות משתייכים לשלושה סוגי SCCmec עיקריים: 1, 2 ו-3, הנבדלים זה מזה בגודלם ובהרכבם הגנטי.
MRSA במוסדות בריאות
(Health care Associated MRSA - HA MRSA)
למרות זיהוי MRSA כבר בתחילת שנות ה-60, רק באמצע שנות ה-80 חלה עלייה משמעותית במספר מקרי הזיהום בחיידק במוסדות בריאות. העלייה בשיעור הזיהומים משקפת את העלייה בגיל החולים, במספר החולים עם מחלות קשות ובשימוש במכשירים ובטכניקות רפואיות מתקדמות.
גם בשנים האחרונות ממשיכה העלייה בשיעור הזיהומים הנגרמים על ידי MRSA בבתי חולים. מתוך 125,969 אשפוזים עקב זיהומי סטפאאורוס אשר דווחו על ידי המרכז לבקרת מחלות בארצות הברית (CDC) בשנים 2000-1999, 43.2 אחוז היו עמידים למטיצילין.
בעבודה גדולה שסקרה זיהומים בזרם הדם שנרכשו במוסדות בריאות, שיעור ה-MRSA מכלל זיהומי סטפ. אאוראוס עלה מ-22 אחוז בשנת 1995 ל-57 אחוז ב-2001. כמו כן, בדיווח של ה-NNIS
(National Nosocomial Infections Surveilance system) מ-2003, 64.4 אחוז מזיהומי סטפ. אאוראוס ביחידות לטיפול נמרץ בארצות הברית נגרמו על ידי MRSA לעומת 35.9 אחוז ב-1992. העלייה בשיעור הזיהומים מדווחת ברחבי העולם, אולם יש שוני גיאוגרפי בשיעורי הזיהומים. באירופה לדוגמה, נעים שיעורי הזיהומים עם MRSA בין 0.5 אחוזים לאחוז אחד, ובאיסלנד ודנמרק - 44 אחוז.
זיהומי MRSA בבית חולים גורמים ככל הנראה לתחלואה ותמותה גבוהים יותר מאלה הנגרמים על ידי Methicillin sensitive Staphylococcus aureus) MSSA).
הסיבות לכך אינן לגמרי ברורות.יש הסבורים שאלימות החיידק עצמו גורמת להבדל בתחלואה ובתמותה ואילו אחרים סבורים שמאפייני החולים הרוכשים זיהום עם MRSA מכתיבים את ההבדל. החולים בדרך כלל מבוגרים וחולים יותר. סברה נוספת היא שהטיפול בוונקומיצין הוא תת אופטימלי ולכן התוצאות הקליניות רעות יותר. מחקרים שהשוו טיפול בוונקומיצין עם אנטיביוטיקה ממשפחת הבטא לקטם לטיפול בזיהומים חודרניים שנגרמו על ידי MSSA, הראו יותר כישלון מיקרוביולוגי וקליני בטיפול בוונקומיצין.
MRSA בקהילה
Community Associated MRSA) CA MRSA)
בשנים האחרונות החלו להופיע ברחבי העולם זיהומי MRSA באנשים ללא גורמי הסיכון האופייניים לזיהום בחיידק זה. בשנת 1993 בודד באוסטרליה חיידק MRSA בעל אלמנט גנטי ייחודי. חיידק זה גרם לזיהומים בקרב אוכלוסיית ילידים אבורג'ינים שלא היו מעולם בקשר עם מוסד בריאות. בארצות הברית דווח ב-1999-1997 על ארבעה מקרים של דלקת ריאות סוערת וקטלנית בילדים בריאים מהקהילה. הזיהום נגרם על ידי MRSA הנושא אלמנט גנטי חדש המכונה SCCmec 4. בהמשך נוספו דיווחים מרחבי העולם על זיהומים עם MRSA בחולים ללא קשר למערכת הבריאות.
בנוסף להעדר קשר למערכת בריאות אפיינו את זן ה-MRSA החדש מספר תכונות: רוב הזיהומים שנגרמו על ידו היו זיהומי עור ורקמות רכות והוא גרם להתפרצויות במשפחות ובאוכלוסיות הנמצאות בתנאים של היגיינה ירודה ובצפיפות כגון אסירים ושחקנים בקבוצות ספורט. בניגוד ל-MRSA הקלאסי בבתי חולים, MRSA מהקהילה עמיד רק לתכשירי אנטיביוטיקה ממשפחת הבטא לקטם ורגיש לטווח רחב יחסית של תכשירי אנטיביוטיקה כגון רספרים, קלינדהמיצין ואריתרומיצין.
בחלק מהזיהומים הקשים יותר שנגרמו על ידי MRSA בקהילה נמצא טוקסין PVL שנחשד כגורם וירולנטי המסביר את אלימות החיידק. גורם זה לא נמצא בכל חיידקי ה-MRSA שגרמו לזיהומים היותר חודרניים וקשים ומן הצד השני נמצא גם בזני MRSA שגרמו לזיהומים שטחיים וקלים יותר.
מחקרים שונים הדגימו כי מקורו של CA MRSA בזני MSSA שהכילו את הגורם הוירולנטי, ה-PVL, ורכשו את האלמנט הגנטי הייחודי, ה-SCCmec.
בדומה ל-MRSA שמקורו בבתי חולים, נשאות של CA MRSA מהווה גורם סיכון לזיהום בחיידק. במחקר שנערך בחיילים בצבא ארצות הברית, קולוניזציה עם CA MRSA המכיל PVL היתה גורם סיכון משמעותי לזיהומי עור ורקמות רכות.
יש שונות גיאוגרפית בשכיחות הימצאות ה-CA MRSA. בארצות הברית למשל, יש שכיחות גבוהה יותר של MRSA בקהילה במדינות בדרום ארצות הברית לעומת בצפונה. כמו כן, יש שונות בין מדינות שונות בעולם.
לאחרונה תועדה התפשטות של זני CA MRSA בבתי חולים שונים ברחבי ארצות הברית ובחלק מבתי החולים אף היתה החלפה של זני בית החולים הקלאסיים על ידי זן קהילה שהפך לזן השליט בבית החולים.
CA MRSA בישראל
הדיווח והראשון והיחיד עד כה על זיהום עם CA MRSA בישראל הוא מבית החולים שיבא בתל השומר. קווינט וחבריו דיווחו בשנת על התפרצות של CA MRSA בטיפול נמרץ יילודים. בהתפרצות חלו תשעה פגים והיא נמשכה מנובמבר 2002 עד דצמבר 2003. לא נצפה הבדל בהסתמנות הקלינית או בתמותה בין פגים שרכשו זיהום ב- CA MRSA לבין פגים שרכשו זיהום עם MSSA או HA MRSA. זן ה-CA MRSA בהתפרצות זו היה SCCmec 4 אך לא הכיל את הגן Panton - Valentine - Leukocidine) PVL), שנחשב בחלק מהמחקרים לגורם הוירולנטי בזני ה-CA MRSA.
בסקר בקרב אוכלוסיית הורים וילדים במחוז תל אביב מצאו החוקרים אחוז נמוך של CA MRSA. במהלך פברואר עד אוקטובר 2002, נסקרו 3,373 ילדים והוריהם לנוכחות סטפ. אאוראוס בנחיריים. נשאות לסטפ. אאוראוס נמצאה ב-17.2 אחוז מהנסקרים, מתוכם חמישה היו MRSA ורק שניים מהחמישה התאימו לפרופיל הגנטי של CA MRSA.
בידודי ה-CA MRSA לא הכילו גם הם את הגן ל-PVL והפרופיל שלהם ב-pulse filed gel electrophoresis תאם את זה של זן ה-MSSA השכיח בישראל. פרט לעבודות אלו, אין נתונים לגבי הימצאות CA MRSA בישראל.
פתוגנזה של זיהום ב-MRSA
גורמי האלימות של MRSA אינם שונים מאלה של MSSA, אולם לזני MRSA מסוימים יש, ככל הנראה, גורמים או רקע גנטי המגבירים את אלימותם או את יכולתם לגרום לתסמונות קליניות מסוימות.
קולוניזציה לעומת מחלה
סטפילוקוקוס אאוראוס יכול להיות חלק מהפלורה הטבעית על הגוף או כפתוגן.
כ-20 אחוז מהאוכלוסיה הם נשאים קבועים של סטפ. אאוראוס וכ-30 אחוז הנם נשאים לסירוגין. האתר השכיח לקולוניזציה של סטפ. אאוראוס הוא הנחיריים אולם יכולה להיות קולוניזציה גם באתרים נוספים כגון בתי השחי, מפשעות ודרכי העיכול.
הסיכון ללקות בזיהום עם סטפ. אאוראוס גבוה יותר בנשאים והזיהום מתרחש בדרך כלל על ידי הזן הנישא על החולה. זיהום מתרחש כאשר יש ירידה בתנגודת החיסונית, הפרעה בשלמות העור או פרוצדורות כגון החדרת קטטר תוך ורידי מרכזי או ניתוח. בנוסף, מהווים הנשאים מאגר להתפשטות החיידק לחולים אחרים במוסדות בריאות או בקהילה.
גורמי אלימות
לסטפ. אאוראוס יש מגוון רחב של גורמי אלימות, חלקם מבני וחלקם תוצרים המופרשים לסביבה. יש לציין כי לכל גורם אלימות בחיידק יכולים להיות מספר תפקידים בתהליך הזיהום ומצד שני יש מספר פקטורים הגורמים לאותה תוצאה.
מעל פי שטח הפנים של סטפ. אאוראוס יש מספר חלבונים הנקראים MSCRAMMs
("Microbial Surface Components Recognizing Adhesive Matrix Molecules").
חלבונים אלה מסייעים לחיידק להיצמד לרקמות שונות כגון קולגן, פיברונקטין ופיברינוגן. לחלבונים אלה תפקיד מכריע בזיהומי עצם ומפרקים, זיהומים הקשורים לגופים זרים וזיהומים אנדווסקולריים כגון אנדוקרדיטיס.
ברגע שהחיידק נצמד לרקמה או לגוף זר, הוא מסוגל להתרבות ולהתקיים לאורך זמן על ידי יצירת ביופילם. הביופילם מאפשר לחיידק להתחמק ממנגנוני ההגנה של הגוף ומתכשירי אנטיביוטיקה. יצירת ביופילם היא אחת הסיבות לכך שקשה לטפל בזיהום סטפילוקוקלי בנוכחות גוף זר ללא הסרתו. סטפ. אאוראוס יכול לחדור ולחיות בתוך תאים, כגון תאים אנדותליאליים ועל ידי כך לחמוק ממנגנוני ההגנה, בעיקר באנדוקרדיטיס.
מנגנון אחר התורם להישארות החיידק בגוף לאורך זמן הוא יצירת small-colony variants"": החיידק נשאר בתוך תאי המאכסן בצורה "שקטה", מבלי לגרום נזק משמעותי לתא המאכסן, ולהפוך חזרה לצורה האלימה יותר כאשר התנאים מתאימים. מנגנון זה יכול להסביר זיהומים חוזרים על ידי סטפ. אאוראוס.
בנוסף, מפריש החיידק חלבונים רבים אחרים המונעים את הפעלת מנגנוני ההגנה של הגוף, ביניהם לאוקוצידינים כגון PVL הגורמים להרס של לויקוציטים על ידי יצירת חורים בדופן הלויקוציט. במהלך זיהום, מפריש החיידק מספר אנזימים כגון פרוטיאז, ליפאז ואלסטאז המסייעים לחיידק לחדור ולהרוס רקמות.
סטפ. אאוראוס גורם לשוק ספטי על ידי הפעלה הן של מערכת החיסון והן של מערכת הקרישה של המארח. זנים מסוימים של סטפ. אאוראוס יוצרים Super antigens המפרישים טוקסינים וגורמים למחלות המתווכות על ידי טוקסין, כגון להרעלות מזון ול-Toxic shock syndrome.
מאפייני המאכסן משפיעים אף הם על הרגישות לזיהומים סטפילוקוקליים. מאפיינים אלה לא ברורים לחלוטין. במחקר שבוצע בחולים עם בקטרמיה מסטפ. אאוראוס, התמותה היתה גבוהה יותר בחולים אשר פיתחו בקטרמיה מבלי להיות נשאים קודמים של החיידק. רוב הזיהומים בנשאים היו עם הזן אותו נשאו קודם וייתכן שהנשאות אמנם מהווה גורם סיכון לזיהום אך מהווה גם גורם מגן מפני זיהומים קשים ותמותה ("חיסוניות חלקית").
חשוב לציין שיש שונות בין זני סטפ. אאוראוס שונים ביחס להימצאות גורמי האלימות, ומכאן היכולת של זנים מסוימים לגרום למחלה אלימה יותר או לסינדרום ייחודי.
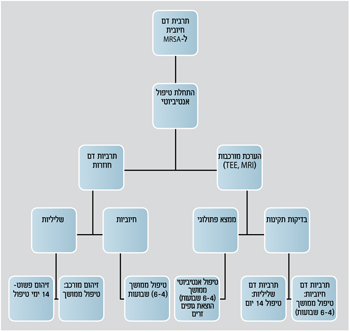
הערכת מורכבות הזיהום בבקטרמיה
הערכת מורכבות הזיהום בסטפ. אאוראוס היא שלב קריטי בהחלטה על אופי ומשך הטיפול. אפילו תרבית בודדת של סטפ. אאוראוס (בקבוק אחד) מחייבת התחלת טיפול אמפירי, לקיחת תרביות דם נוספות למעקב ובירור מקור הזיהום והיקפו.
מקורות שכיחים לבקטרמיה הם קטטרים תוך ורידיים, זיהום רקמות רכות ופנאומוניה. כשליש מהחולים עם בקטרמיה מסטפ. אאוראוס יפתחו סיבוך שיתבטא בפיזור מטסטטי של הזיהום, כתוצאה מזריעה המטוגנית או מהתפשטות מקומית.
האתרים המרוחקים הנזרעים בשכיחות גבוהה הם עצמות ופרקים, בעיקר בנוכחות גופים זרים, החלל האפידורלי, מסתמי הלב ואיברים כגון הטחול והכליות.
גורם הסיכון העיקרי לזיהום מסובך בסטפ. אאוראוס היה תרביות דם חיוביות 96-48 שעות מתרבית דם ראשונה. גורמים אחרים היו: זיהום שנרכש בקהילה, ממצא עורי המצביע על זיהום סיסטמי חריף וחום שנמשך 72 שעות אחרי תרבית דם ראשונה. בחולים אלה נדרש בירור אגרסיבי (כגון MRI לשלילת אבצס אפידוראלי ואקו לב לשלילת אנדוקרדיטיס) כדי לוודא שכל אתרי הזיהום זוהו ושמשך הטיפול מותאם להיקף הזיהום.
מספר מחקרים הצביעו בבירור על העליונות של אקו תוך ושתי (TEE) לעומת אקו רגיל (TTE) באבחון או שלילה של אנדוקרדיטיס בחולים עם בקטרמיה של סטפ. אאוראוס. באחד המחקרים בדקו בצורה פרוספקטיבית 103 חולים עם בקטרמיה. אנדוקרדיטיס נמצאה ב-26 (25 אחוז) ב-TEE לעומת שבעה (6.8 אחוזים( ב-TTE. בנוסף, TEE רגיש יותר באבחון סיבוכי אנדוקרדיטיס כגון אבצס תוך לבבי או פרפורציה של המסתם.
יש שתי אוכלוסיות עיקריות שבהן TEE הוא קריטי בעיבוד בקטרמיה עם סטפ. אאוראוס: 1. חולים בסיכון גבוה לסיבוכים תוך לבביים כגון חולים עם מסתם תותב, קוצב, בקטרמיה ממושכת או הפרעות הולכה בא.ק.ג. 2. חולים בסיכון נמוך לאנדוקרדיטיס, שבהם ניתן לשקול קורס טיפול קצר. TEE תקין בחולים אלה שולל למעשה אנדוקרדיטיס ובהעדר סיבוכים אחרים, ניתן בחולים אלה לטפל כבקטרמיה פשוטה.
אחד הגורמים העיקריים להצלחת טיפול בחולים עם בקטרמיה מסטפ אאוראוס הוא הוצאה מוקדמת של צנתרים תוך ורידיים או גופים זרים מזוהמים. בחולים שבהם לא הוצאו גופים זרים, אחוז החזרה של הבקטרמיה גבוה בהרבה. בעבודה שבדקה 244 חולים עם בקטרמיה מסטפ. אאוראוס, ב-56 אחוז מתוך 23 חולים שבהם לא הוצא גוף זר, היתה חזרה של הזיהום או מוות, לעומת 16 אחוז מ-221 חולים שבהם כן הוצאו גופים זרים או שלא נשאו גוף זר.
הנושא היותר שנוי במחלוקת בחולים עם בקטרמיה ואנדוקרדיטיס הוא תזמון ניתוח החלפת מסתם בחולים עם אנדוקרדיטיס שמאלית. באופן היסטורי, מטופלים חולים עם אנדוקרדיטיס מסטפ. אאוראוס שמרנית ומופנים להחלפת מסתם כאשר הם עונים לקריטריונים המקובלים להפניה לניתוח כגון אי ספיקת לב, חדירת הזיהום למיוקרד, סיכון גבוה לסיבוך מטסטטי או כישלון של הטיפול האנטיביוטי. לאחרונה הראו מספר עבודות שיפור בהישרדות חולים עם אנדוקרדיטיס עם סטפ. אאוראוס אשר הופנו לניתוח מוקדם. שיפור זה לא נצפה בחולים עם אנדוקרדיטיס מחיידקים אחרים. למרות שטרם הובררו לגמרי התזמון והאינדיקציות המדויקות, ניתוח מוקדם יכול להות יתרון הישרדותי בחולים רבים עם אנדוקרדיטיס מסטפ. אאוראוס.
משך הטיפול האנטיביוטי
משך הטיפול האנטיביוטי בזיהום סטפילוקוקלי תלוי במורכבות הזיהום. בעבר קיבלו כל החולים עם בקטרמיה עם סטפ. אאורואוס קורס ממושך בן ארבעה עד שישה שבועות טיפול. מחקרים רטרוספקטיביים שפורסמו בשנות ה-90 הדגימו הצלחה של קורס אנטיביוטי קצר יחסית (10-14 ימים) בחולים עם בקטרמיה ללא עדות לסיבוכים. יש לציין כי בעבודות אלו, בחולים שקיבלו קורס קצר מעשרה ימים, היתה חזרה של הזיהום בעד 66 אחוז מהחולים.
אנליזה מאוחרת יותר של מחקרים קליניים רנדומליים שבדקו משך טיפול הדגימה אחוזי הצלחה נמוכים בחולים שקיבלו קורס קצר מ-14 ימי אנטיביוטיקה.
כאשר שוקלים טיפול קצר של "רק" 14 יום בחולה עם בקטרמיה עם סטפ. אאוראוס בנוכחות קטטר וסקולרי, יש לוודא כי הקטטר הוצא וכי החולה עומד בנוסף בקריטריונים הבאים: 1. נשללה אנדוקרדיטיס בTEE-. 2. לחולה אין גוף זר או משתל כגון מסתם, קוצב, מפרק מלאכותי. 3. תרביות מעקב יומיים עד ארבעה ימים לאחר הבקטרמיה הראשונית חייבות להיות שליליות. 4. החולה ללא חום תוך 72 שעות מהתחלת טיפול אנטיביוטי מתאים. 5. לחולה אין עדות קלינית לזיהום מרוחק.
תכשירים אנטיביוטיים לטיפול ב-MRSA
יש מספר תכשירים אנטיביוטיים המיועדים לטיפול בזיהומי סטפ. אאוראוס, כולל בקטרמיה. רק שניים מהם עם יעילות מוכחת בבקטרמיה, Vancomycin ו-Daptomycin:
Vancomycin - וונקומיצין הוא הטיפול העיקרי בזיהומי MRSA ב-40 השנים האחרונות. לאחרונה גוברת הדאגה לנוכח יעילות פחותה של וונקומיצין בטיפול בזיהומים קשים והתפתחות עמידות חלקית או מלאה לתרופה.
כאשר משווים טיפול בוונקומיצין לעומת טיפול בבטא לקטם, בחולים עם בקטרמיה עם MSSA, יש כישלון בקטריולוגי וקליני באחוזים גבוהים יותר בחולים שקיבלו וונקומיצין. גם בטיפול בבקטרמיה ואנדוקרדיטיס עם MRSA יש נטייה לבקטרמיה ארוכה יותר בחולים שטופלו בוונקומיצין.
בעשור האחרון התגברו הדיווחים על כישלון בטיפול עם וונקומיצין בחולים עם זיהום עם MRSA שהיה לכאורה רגיש לוונקומיצין. מסתבר שבחולים אלה יש אוכלוסיה הטרוגנית של זני MRSA וכמה מהחיידקים עמידים חלקית לוונקומיצין. מדובר בדרך כלל בחולים עם עומס חיידקי גבוה מאוד אשר טופלו במינונים יחסית נמוכים של וונקומיצין. מצב זה הוביל לסלקציה של הזנים היחסית עמידים ולכשלון הטיפול בוונקומיצין. גם בזני MRSA הרגישים באופן מלא לוונקומיצין נמצא אחוז גבוה של כישלון קליני כאשר ה-MIC לוונקומיצין הוא מעל 1 מיק"ג/ מ"ל.
לנוכח הקשר בין MIC גבוה יותר לכישלון קליני, יש נטייה להעלות את מינון הוונקומיצין בטיפול בבקטרמיה או באנדוקרדיטיס עם MRSA ולשמור על רמות שפל גבוהות יותר. נכון להיום, רמות השפל המומלצות הן בין 15-10 מיק"ג/ מ"ל לעומת בין 10-5 מיק"ג/מ"ל בעבר. רמות השפל הללו מושגות בדרך כלל במינונים של 15 מ"ג לק"ג פעמיים ביום, לעומת המינון המסורתי של 1 גרם פעמיים ביום.
במשך הזמן נוסו מספר שילובים של תכשירי אנטיביוטיקה שונים כתוספת לוונקומיצין במטרה להגדיל את אחוזי הריפוי. ריפמפין היא תרופה עם פעילות אנטיסטפילוקוקלית טובה וחדירות מצוינת לרקמות. ניסיון להוסיף ריפמפין לטיפול בוונקומיצין לא הביא לתוצאות המצופות עקב התפתחות מהירה של עמידות לריפמפין תוך כדי טיפול ואחוז גבוה של תופעות לוואי כגון הפרעה בתפקודי כבד ותגובות בין-תרופתיות. ההמלצה כיום היא לשקול תוספת של ריפמפין לטיפול רק לאחר וידוא תרביות דם שליליות ל-MRSA כדי להקטין את הסיכון לעמידות.
תוספת של Gentamycin לטיפול בבקטרמיה ואנדוקרדיטיס קיצרה במעט את משך הבקטרמיה אך לא שיפרה את אחוזי ההחלמה. יתרה מכך, תוספת של גנטהמיצין לוונקומיצין מעלה את הסיכון לרעילות כלייתית.
Daptomycin - Daptomycin הוא תכשיר בקטריוצידי אשר אושר לשימוש כטיפול בבקטרמיה ובאנדוקרדיטיס ימנית עם MRSA. דפטומיצין הוכח כיעיל כמו הטיפול הסטנדרטי בוונקומיצין. למרות זאת, חשוב לציין כי בחלק לא מבוטל מהחולים שנכשלו בטיפול בדפטומיצין נצפתה התפתחות של עמידות לאנטיביוטיקה תוך כדי טיפול. ממצא זה מעלה ספקות לגבי יעילות התרופה בזיהומים מסובכים שבהם יש זיהום עמוק ונדרש טיפול לאורך זמן. ייתכן שבחולים אלה יידרש טיפול במינון כפול כדי למנוע התפתחות עמידות.
הטיפול ב-Daptomycin בדלקת ריאות אינו מומלץ משום שהתרופה עוברת אינאקטיבציה על ידי הסורפקטנט בריאות.
התכשירים הבאים לא הוכחו כיעילים לטיפול בבקטרמיה או באנדוקרדיטיס עם MRSA ולכן נשקלים כטיפול רק במקרה של כישלון עם וונקומיצין או דפטומיצין:
Lynezolid - לינזוליד הוא תכשיר בקטריוסטטי עם פעילות כנגד MRSA, הוא לא נבדק ולכן גם לא אושר כטיפול לבקטרמיה או לאנדוקרדיטיס. מדיווחים המצטברים בספרות נרשמו הצלחות כמו גם כשלונות בטיפול בתרופה. בסיכום מספר עבודות, לינזוליד נמצא שווה ערך לוונקומיצין מבחינת אחוזי החלמה.
לאחרונה הופסק מחקר קליני אירופאי שהשווה לינזוליד לוונקומיצין בזיהומים קשים עם MRSA. המחקר הופסק עקב תמותה גבוהה של החולים בקבוצת הלינזוליד. התמותה נצפתה בחולים שבהם היה זיהום בחיידקים גרם שליליים או זיהום מעורב, אך לא בחולים עם זיהום בחיידקים גרם חיוביים בלבד. משמעות ממצא זה אינה ברורה לחלוטין אך נכון להיום התכשיר אינו מומלץ לשימוש רוטיני בזיהומים קשים עם MRSA.
(resprim) Trimetoprim – sulfamethoxazole - בעבודות שהשוו טיפול ברספרים לוונקומיצין נמצא אחוז תגובה דומה בקרב חולים עם בקטרמיה, אנדוקרדיטיס ימנית וטרומבופלביטיס ספטית עם MRSA. רספרים הוא בקטריוצידי עם אפקט הרג מהיר ויכול להוות חלופה הולמת לוונקומיצין כטיפול חליפי במקרה של כישלון או תופעות לוואי. כמו כן מהווה רספרים אופציה לטיפול בזיהומי עור הנגרמים על ידי MRSA CA.
תרופות חדשות
Tigacyclin - טטרציקלין חדש, בקטריוסטטי,עם יעילות כנגד MRSA. עדיין לא נוסה קלינית. אחת הבעיות הצפויות עם Tigacyclin היא חוסר יכולת של התרופה להגיע לרמה מקסימלית של יותר מ-1 מיק"ג /מ"ל בסרום. ממצא זה יכול להגביל את היכולת לטפל בתרופה בזיהומים מסובכים הדורשים ריכוזי אנטיביוטיקה גבוהים.
Lypoglycopeptides - יש שלוש תרופות חדשות ממשפחת הגליקופפטידים (בדומה לוונקומיצין) הנמצאות בשלבים שונים של ניסוי קליני ואישור. התוצאות עד עתה מראות אחוזי הצלחה דומים לוונקומיצין במגוון זיהומים עם MRSA.
צפלוספורינים - Ceftobiprol ו-Ceftarolin הם שני צפלוספורינים רחבי טווח בעלי יעילות כנגד MRSA ואפיניות גבוהה ל-Penicillin binding proteins 2a. לאור העובדה שתכשירים ממשפחת הבטא לקטם יעילים ביותר כנגד סטפ. אאוראוס, מעוררות תרופות אלו סקרנות ותקווה לגבי היעילות שלהן בטיפול בזיהומים עם MRSA. נכון להיום, אין בידנו נתונים לגבי יעילות שתי תרופות אלו בבקטרמיה או באנדוקרדיטיס.
מניעה
לאור העלייה בשכיחות ובמורכבות זיהומי MRSA במוסדות בריאות והתפתחות והתפשטות זני MRSA בקהילה ולאור האתגר הטיפולי שמציגים חיידקים אלה, עולה חשיבות מניעת התפשטות MRSA במוסדות בריאות ובקהילה.
כדי לנסות להפחית את הזיהומים הנרכשים על ידי MRSA במוסדות בריאות, פרסם ה-Society for Health care Epidemiology of America המלצות שכללו סיקור אקטיבי של חולים בסיכון להיות נשאי MRSA ובידוד מגע של חולים שזוהו כנשאים.
סיקור פאסיבי של נשאות ל-MRSA המתבטא בלקיחת תרביות קליניות בלבד מצליח לזהות 11 אחוז עד 30 אחוז מהנשאים. סיקור פאסיבי כזה גורם לרוב נשאי ה-MRSA להמשיך ולהוות מאגר להעברת החיידק בתוך מוסדות הבריאות.
גורמי הסיכון הקלאסיים לנשאות ל-MRSA הם אשפוז לאחרונה, טיפול אנטיביוטי בשלושה חודשים לפני האשפוז, גיל מבוגר, שהות בבית אבות ונוכחות של נגעים עוריים פתוחים ו/או גופים זרים. גורמי הסיכון משתנים מעט בהתאם לאוכלוסיית החולים שנבדקה ולפי מיקום גיאוגרפי. עם הופעת CA MRSA והפיכתו לפתוגן עיקרי בחלק מבתי החולים, השתנו או נוספו גורמי הסיכון לנשאות. גורם הסיכון העיקרי לנשאות של CA MRSA הוא אשפוז עקב זיהום עור ורקמות רכות. כל מוסד בריאות יכול וצריך לבצע הערכה של החולים שנחשבים חולים בסיכון גבוה לנשאות החיידק ולשקול לסקור אותם בהתאם. גורמי הסיכון יכולים להשתנות לאורך זמן גם בתוך מוסד נתון ולכן יש לבצע הערכה תקופתית ולעדכן את קבוצות החולים בסיכון. סיקור רק של החולים בסיכון יכול למנוע סיקור מיותר של חולים (חיסכון של עד 46 אחוז) ועדיין לשמור על רגישות גבוהה וזיהוי רוב הנשאים ( 89 אחוז).
שימוש בשיטות זיהוי מהירות ומדויקות כגון PCR מעלה את יעילות הזיהוי ומאפשר בידוד מהיר של נשאים.
ד"ר פנינה שטרית, היחידה למחלות זיהומיות, בית החולים מאיר |