|
ההתעניינות בכולסטרול כגורם סיכון לטרשת עורקים החלה עוד בתחילת המאה הקודמת, כאשר הוכח שהזנת ארנבות בתזונה עתירת כולסטרול גורמת לטרשת עורקים. לאחר זיהוי מבנה הליפופרוטאינים הספציפיים, הושם הדגש על הנזק הנגרם על ידי רמות גבוהות של LDLc (Cholesterol Low Density Lipoprotein) לעומת תפקידו המגן של high Density Cholesterol) HDLc (Lipoprotein. במקביל למחקרי תצפית אפידמיולוגים, שהתמקדו בקשר בין רמות הכולסטרול בדם למחלת הלב הכלילית, נעשו נסיונות להוכיח שהפחתת רמת ה-LDLc בדם באמצעים תזונתיים (תזונה דלת שומן רווי), תרופתיים (פיברטים, רזינים וניאצין) וכירורגיים (קיצור המעי הדק) מפחיתה את התחלואה והתמותה ממחלות אלו.
למרות שחלק גדול מהמחקרים הצליח להדגים ירידה בתחלואה ותמותה קרדיווסקולרית, היה קושי להוכיח ירידה בתמותה הכללית (overall mortality) על ידי אמצעים מפחיתי כולסטרול בדם. לכישלון זה תרמו ככל הנראה היבטים מתודולוגיים במבנה המחקרים ואולי גם עלייה מקרית ובלתי מוסברת בתמותה מסיבות לא-קרדיווסקולריות, אך הסיבה העיקרית לכך נבעה מחולשתם היחסית של אמצעי הטיפול שהיו קיימים באותה התקופה לשינוי הרכב הליפופרוטאינים בדם1.
הטיפול בדיסליפידמיה עבר מהפך בשנות ה-80, עם הופעתם של הסטטינים לשימוש קליני. גילוי הסטטינים מיוחס למדען יפני בשם Akira Endo, אשר בדק את ההיפותזה שפטריות מפרישות חומרים מעכבי סינתזה של כולסטרול כחלק מאמצעי ההתגוננות נגד פרזיטים. לאחר סקירת כ-6,000 תרכובות כימיות שונות, הוא זיהה שלושה מטבוליטים של Penicillium citrinum בעלי פעילות המעכבת סינתזת כולסטרול, ומתוכם בודד הסטטין הראשון, 3,2Mevastatin.
אנדו ושותפיו זיהו שהחומר דומה במבנהו לתרכובת HMGCoA ומעכב באופן תחרותי את פעילות האנזים HMGCoA Reductase, האחראי על השלב מגביל הקצב בתהליך הסינתזה של כולסטרול בתאים ובעיקר בכבד (ציור 1).
ציור 1. המסלול הביוכימי של סינתזת כולסטרול
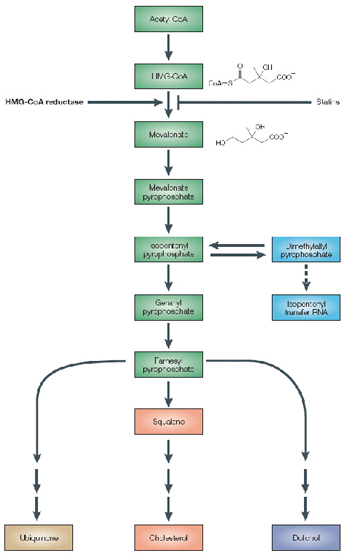
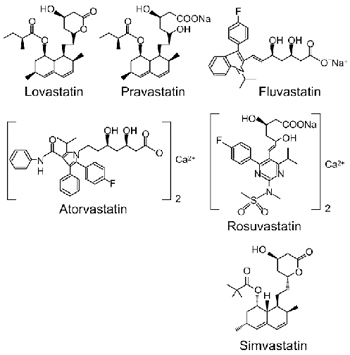
מכאן הייתה הדרך קצרה ליצירת תרופות נוספות המעכבות את פעילות האנזים, אשר כונו סטטינים (ציור 2).
ציור מס. 2 המבנה הביוכימי של הסטטינים
פרמקולוגיה
לובסטטין, פרבסטטין וסימבסטטין הינם חומרים טבעיים המיוצרים על ידיי פטריות, בעוד שאטורבסטטין, פלובסטטין ורוסובסטטין מיוצרים באופן סינטטי2.
מבנה המולקולה מכיל 3 חלקים: חלק הדומה במבנהו ל-3HMGCoA, חלק המכיל טבעת הידרופובית האחראית על קישור המולקולה לאנזים, ושרשרות צדדיות המקנות למולקולה תכונות נוספות כגון מסיסות. פרבסטטין ורוסובסטטין הינם מסיסי-מים (הידרופילים), בעוד שהסטטינים האחרים מתמוססים בשומן (ליפופילים). כל הסטטינים נקשרים לחלק הפעיל של האנזים ומונעים התקשרות של הסובסטרט HMGCoA. כולם נספגים מהר במעי ומגיעים לשיא הריכוז בדם בתוך ארבע שעות. כיוון שזמן מחצית החיים של רוב הסטטינים קצר יחסית (שעה עד שלוש שעות), יעילותם בהפחתת הסינתזה של כולסטרול גבוהה יותר כאשר הם נלקחים בלילה, לקראת השעות שבהן קיימת סינתזה מוגברת של כולסטרול בכבד. יוצאים מהכלל הם אטורבטטין ורוסובסטטין, עם זמן מחצית חיים ארוך ולכן תלות מופחתת בעיתוי נטילת התרופה. למרות שספיגתם של חלק מהסטטינים מעוכבת בנוכחות אוכל בקיבה, לא הוכח שתכונה זו משפיעה על יעילותם בהפחתת רמת הכולסטרול בדם ולכן ניתן לקחתם לאחר ארוחת הערב או לפני השינה (טבלה 1).
הפירוק של רוב הסטטינים נעשה בכבד על ידי מערכת האנזימים P450, הכוללת מעל 30 אנזימים שונים. לובסטטין, סימבסטטין ואטורבסטטין מפורקים על ידי CYP3A4 ופלובסטטין מפורק על ידי CYP2C9. יוצאים מהכלל הם פרבסטטין ורוסובסטטין אשר כמעט ואינם עוברים פירוק על ידי אנזימי P450. תכונה זו מקנה להם יתרון מסוים בכל הקשור לאינטראקציה עם תרופות מעכבות P450 (טבלה 2)4.

מסלול ההפרשה העיקרי של הסטטינים מהגוף הוא דרך המרה לאחר פירוק בכבד, אך ברוב הסטטינים קיימת גם הפרשה כלייתית האחראית לסילוק עשרה אחוזים עד 20 אחוז מהתרופה. עובדה זו צריכה לבוא בחשבון בחולים עם אי ספיקת כליות. הפרשה כלייתית נמוכה יותר (סביב חמישה אחוזים) קיימת בפלובסטטין ובאטורבסטטין.
השפעות ביוכימיות
השפעתם הביוכימית הבולטת ביותר של הסטטינים היא הפחתת רמת ה-LDLc בדם, המגיעה לשיאה כבר לאחר כשישה שבועות טיפול ונשארת יציבה לאחר מכן עם וריאביליות נמוכה לאורך הזמן. אמנם תוארה תופעה של בריחה
(escape) מהשפעת הסטטינים, אך עושה רושם שתופעה זו נדירה וברוב המקרים שבהם נצפית עלייה ברמת ה-LDLc תוך כדי טיפול בסטטין, מתברר שהמטופל לא נטל את התרופה בימים שקדמו לבדיקה.
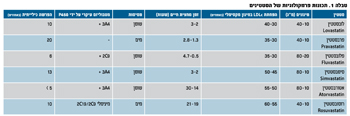
עוצמת הירידה ברמת ה-LDLc מגיעה ל-60-25 אחוז ותלויה בסוג הסטטין ובמינונו (טבלה 1). הבדלי העוצמה נצפים כבר במינונים הנמוכים של כל סטטין. על מנת להשיג ירידה זהה למינון סטנדרטי של סימבסטטין (שנחשב לטיפול ההתחלתי המומלץ ברוב המטופלים), יש צורך במינון כפול של לובסטטין, פרבסטטין ופלובסטטין, בעוד שתרופות חזקות יותר מסוגלות להשיג אותה תוצאה בחצי המינון (אטורבסטטין) ואפילו ברבע המינון (רוסובסטטין). העלאת מינון הסטטין משיגה ירידה יחסית נוספת דומה בכל הסטטינים: כל הכפלת מינון התרופה פי שניים גורמת בממוצע לירידה נוספת של שישה עד שבעה אחוזים ברמת ה-5LDLc.
צריך לזכור שמדובר בירידה ממוצעת, אך התגובה האינדיבידואלית יכולה להשתנות ויש מטופלים המפתיעים לטובה עם ירידה גדולה מהצפוי, בעוד שאחרים עלולים לא להגיב כלל.
השפעת הסטטינים על מרכיבי הליפידוגרם האחרים היא קטנה אך לא זניחה. רמת הטריגליצרידים בדם יכולה לרדת בעשרה עד 20 אחוז ונמצאת בקורלציה ישירה לרמת הטריגליצרידים ההתחלתית, עם ירידה בולטת יותר במטופלים היפרטריגליצרידמים. רמת ה-HDLc עולה באופן מתון (שלושה עד עשרה אחוזים). יש עדויות שהסטטינים מפחיתים גם את רמת ה-IDLc Intermediate Density Lipoprotein)) בחולים עם דיסליפידמיה מסוג III ומעלים את גודל חלקיקי ה-LDL לצורה שנחשבת כפחות אטרוגנית (atherogenic). הערכת מספר החלקיקים האטרוגנים בדם (LDL, VLDL ו-IDL) נחשבת למדד מנבא טוב יותר לטרשת עורקים מאשר תכולת הכולסטרול בחלקיקים אלה.
ניתן להעריך את מספר החלקיקים האטרוגנים באופן ישיר על ידי מדידת רמת ה-apoprotein B בדם (כל חלקיק מכיל מולקולה אחת של apo. B) ובאופן עקיף על ידי חישוב רמת ה-non HDL cholesterol בדם6. לאחרונה נמצא שהסטטינים מפחיתים את רמת הכולסטרול ב-LDL יותר מאשר את מספר החלקיקים האטרוגנים בדם וייתכן שמדידת ה-LDLc כמדד ליעילות הסטטינים גורמת להערכת יתר של יעילותם10,9.
בנוסף להשפעת הסטטינים על מרכיבי הליפידוגרם השונים, יש הוכחות רבות לירידה במרכיבים ביוכימיים נוספים השייכים למסלול המטבולי של mevalonate (ציור 1). עיקר תשומת הלב ניתנה לחומרים עם פעילות דלקתית, כגון: IL6, CRP, קרישת הדם כגון: TPA, PAI-1 ואיגור טסיות. עיכוב הסינתזה של mevalonate מפחית גם את ייצורם של חומרים אלה, וכנראה אחראי לאוסף של תכונות פליוטרופיות (pleiotropic effects) המתבטאות בנוסף בשיפור תפקוד האנדותל, בהפחתת פרוליפרציה של תאי שריר חלק ובהשפעות נוגדות-חמצון12,11.
עוצמת התכונות הפליוטרופיות של הסטטינים נמצאת כנראה בקורלציה עם עוצמת ההפחתה ברמת ה-LDL בדם.
יעילות קלינית
בשנת 1994 פורסם המחקר הקליני פורץ הדרך הראשון (The Scandinavian Simvastatin Survival Study) שהוכיח את יעילותו של סימבסטטין בהפחתת תמותה ותחלואה בקרב חולים עם מחלת לב כלילית ורמות LDLc גבוהות7.
מאז פורסמו מחקרים רבים שבדקו את השפעתם של סטטינים שונים על תחלואה ותמותה בקרב מגוון רב של נבדקים: גברים ונשים, צעירים ומבוגרים, עם (מניעה שניונית) או בלי (מניעה ראשונית) מחלות קרדיווסקולריות, עם רמות LDLc גבוהות או תקינות ובשילוב עם גורמי סיכון מסוגים שונים. רובם המכריע של מחקרים אלה הדגים ירידה של 55-20 אחוז בביטוייה השונים של טרשת העורקים, כולל אוטם שריר הלב, תעוקה יציבה ובלתי יציבה, אי ספיקת לב, אירוע מוחי, תמותה קרדיווסקולרית ותמותה כללית. באופן כללי, תועלת הטיפול עלתה בקורלציה עם דרגת הסיכון ההתחלתית, רמת הכולסטרול הבסיסית וחוזק הסטטין8.
כיוצא דופן לכלל זה ניתן לציין את מחקר ה-JUPITER (Justification for the Use of Statins in Primary Prevention: an Intervention Trial Evaluating Rosuvastatin) אשר פורסם בסוף שנת 92008.
למחקר גויסו 17,802 גברים (מעל גיל 55) ונשים (מעל גיל 65) ללא מחלה קרדיווסקולרית, עם רמת LDLc נמוכה מהממוצע באוכלוסיה (חציון 108 מ"ג/ד"ל) ורמת C-reactive protein מעל 2 מ"ג/ליטר. המטופלים חולקו באופן אקראי לשתי קבוצות שטופלו על ידי רוסובסטטין 20 מ"ג או פלצבו. המחקר הופסק טרם הזמן המתוכנן, לאחר תקופת מעקב חציונית של 1.9 שנים בלבד, עקב ירידה של 44 אחוז ב-combined primary end-point,54 אחוז באוטם שריר הלב, 48 אחוז באירועים המוחיים ו-20 אחוז בתמותה הכללית.
תוצאות מפתיעות אלו מעלות לדיון מחודש את חישובי העלות-תועלת בטיפול בסטטינים (שנחשבו עד כה לנמוכים במניעה שניונית אך גבוהים יחסית במניעה ראשונית) ומחייבות את קובעי המדיניות לשקול את הרחבת הטיפול המונע באנשים בריאים עם עדות מעבדתית לדלקת כרונית. יוצאי דופן נוספים, הפעם בכיוון השלילי, הם חולי אי ספיקת הלב ומטופלי דיאליזה. בשתי קבוצות אלו טרם הוכח שסטטינים מביאים לירידה בתחלואה או בתמותה, אולי עקב קיום גורמי סיכון דומיננטיים אחרים המאפילים בעוצמתם על טרשת העורקים10,11.
בדומה למחלות מטבוליות אחרות כגון סוכרת ויתר לחץ דם, השימוש בסטטינים נכנס לקטגוריית הטיפולים המומלצים לכל החיים. תועלת הטיפול עולה לאורך שנות הטיפול, וכיוון שטרם הוכח נזק משמעותי מצטבר בטיפול ממושך, אין סיבה הגיונית להפסיקו במידה שמושגות תוצאות טובות ללא תופעות לוואי. מאידך, קיימות עדויות שהתועלת מסטטינים נשארת גם שנים לאחר הפסקת התרופה12.
תופעה זו, המכונה Metabolic memory או Legacy effect, הוכחה גם בסוכרת ודורשת מחקר נוסף13.
במקביל ליעילות המוכחת של סטטינים בהפחתת מחלות קרדיווסקולריות הקשורות לטרשת העורקים, יש התעניינות באפשרות שהתרופות יעילות גם במחלות אחרות בגין ההשפעות הפליוטרופיות שלהן. דוגמאות לבעיות שבהן הוכחה יעילותם של הסטטינים הן מניעת פרפור פרוזדורים14 ופקקת של הוורידים העמוקים15.
אולם, מחקרי תצפית שהפיחו תקוות ליעילות הסטטינים במניעת הסתיידות של המסתם האאורטלי, דמנציה ואלצהיימר, דחייה של איברים מושתלים, זיהומים סיסטמיים ומחלות אחרות עם מרכיב דלקתי, טרם צלחו את חובת ההוכחה במחקרים מבוקרים16.
הבדלים בין הסטטינים
ההבדל העיקרי בין הסטטינים השונים קשור לעוצמת הירידה ברמת ה-LDLc בדם. כפי שכבר צוין, השוני בעוצמת הירידה מתבטא כבר במינון ההתחלתי של התרופה ונשאר כאשר עולים במינון. לכן, השימוש בסטטינים חזקים, כגון אטורבסטטין ורוסובסטטין, מאפשר הפחתת רמת ה-LDLc בדם לערכים נמוכים יותר במינונים המרביים ובו זמנית מאפשר מזעור תופעות הלוואי על ידי שימוש במינונים נמוכים במטופלים הרגישים לתרופה. אין עדיין הסכמה בשאלה האם יש יתרון קליני לסטטינים החזקים על פני האחרים במידה שיעדי הטיפול
(LDLc) מושגים. יש החושבים שעצם השגת יעדי הטיפול הוא החשוב, בעוד שאחרים גורסים כי השפעה "פליוטרופית" חזקה יותר מקנה לסטטינים החזקים יתרון גם כאשר רמת ה-LDLc המושגת היא זהה17.
יתר ההבדלים בין הסטטינים אינם באים לידי ביטוי במטופל הממוצע, אך ניתן לנצלם במקרים ייחודיים. לדוגמה, בחולה המטופל בתרופות המושפעות מפעילות המערכת P450, כגון נוגדי קרישה או אמיודרון, קיים יתרון בשימוש בסטטינים המשפיעים פחות על מערכת אנזימתית זו (פרבסטטין ורוסובסטטין). בחולים עם אי ספיקת כליות עשוי להיות יתרון לסטטינים אשר פינויים מהגוף מושפע פחות מהתפקוד הכלייתי (אטורבסטטין ופלובסטטין).
מבחינה תיאורטית, עשוי להיות יתרון לסטטינים מסיסי מים (פרבסטטין ורוסובסטטין) בחולים המתלוננים על השפעות מוחיות של התרופה, כגון ירידה בריכוז או קשיי שינה (בעיקר בחולים מבוגרים), אך יתרון זה טרם הוכח בניסויים קליניים. קיימת טענה המבוססת על מחקרי תצפית, שפלובסטטין גורם לפחות פגיעה שרירית מאשר הסטטינים האחרים, אך אין על כך מידע מבוסס ממחקרים מבוקרים24,5.
שיטה אחרת להתגבר על כאבי שרירים היא על ידי שימוש במינונים מזעריים של סטטין בעל עוצמה חזקה (כגון אטורבסטטין או רוסובסטטין), לעתים פעם ביומיים-שלושה. במידת הצורך ניתן לחזק את השפעת הסטטין על ידי תוספת של אזטימיב (ezetimibe).
תופעות לוואי
שיעור תופעות הלוואי של הסטטינים הוא נמוך ורוב המטופלים משיגים את יעדי הטיפול המומלצים במינון סטנדרטי של סטטין מהקו הטיפולי הראשון (בדרך כלל סימבסטטין, 40-20 מ"ג ליום) ללא תופעות לוואי. יחד עם זאת, חלק קטן מהמטופלים מתלונן על תופעות לוואי המחייבות התייחסות. בשנים האחרונות אנו עדים לירידה מתמדת בערכי המטרה של LDLc המומלצים על ידי ועדות המומחים בארצות השונות והמצריכים שימוש במינוני סטטינים גבוהים יותר ולעתים בשילוב עם תרופות נוספות (כגון פיברטים ו-ezetimibe). כיוון ששיעור תופעות הלוואי עולה בקורלציה עם מינון הסטטין, יש מודעות יתר למגבלות השימוש בסטטינים.
תופעת הלוואי השכיחה ביותר קשורה להשפעת הסטטינים על שרירי השלד25,24. תופעה זו מתבטאת בדרך כלל בכאבי שרירים פרוקסימליים. מגוון אופי הכאבים הוא גדול, מאי נוחות קלה וזניחה עד כדי כאב חזק המגביל את יכולת התנועה. לעתים ההפרעה מתבטאת רק בחולשת שרירים, בעייפות או בכאבי פרקים. לפעמים הכאב מלווה בעלייה ברמת ה-CPK בדם, אך במקרים רבים לא נצפית עלייה כזו (למרות הוכחה לנזק מיקרוסקופי בתאים).
הסיבות להיווצרות נזק שרירי אינן ברורות וייתכן שמדובר בהפרעה בייצור אנרגיה במיטוכונדריות. שכיחות התופעה עולה עם מינון הסטטין ויכולה להגיע לחמישה אחוזים עד 20 אחוז מהמטופלים במינוני סטטין גבוהים. בקרב מטופלים המתלוננים על כאבי שרירים קיימת בעייתיות בהוכחת הקשר לתרופה, כיוון שמחקרים מבוקרים הראו שגם בקרב המטופלים בפלצבו קיימת שכיחות גבוהה של כאבי שרירים. לדוגמה, באנליזה שביצעו Thompson ושות' על 80 אלף מטופלים ב-30 מחקרי סטטינים מבוקרים, נמצאה שכיחות מיוזיטיס (כאבי שרירים מלווה בעליית CK פי עשרה או יותר מהנורמה) ב-0.13 אחוזים ממטופלי הסטטינים לעומת 0.12 אחוזים בקרב מטופלי הפלצבו18.
לכן, יש צורך בהפסקה זמנית של הטיפול ולעתים re-challenge על ידי התרופה, על מנת להוכיח (או לשלול) את הקשר בין הסטטין לתלונה.
במקרים קיצוניים, הפגיעה השרירית עלולה להתפתח לרבדומיוליזה
(rhabdomyolysis) המתבטאת בפירוק שריר מסיבי עם עלייה משמעותית ברמת ה-CK בדם, הפרשת מיוגלובין בשתן ואי ספיקת כליות. Thompson מצא 0.16 מקרי רבדומיוליזה לאלף מטופלי סטטינים לעומת 0.12 מקרים לאלף מטופלי פלצבו26. מאפיינים המגבירים את הסיכון לפגיעה שרירית מסטטינים הם גיל מבוגר, מין נקבה, נפח גוף קטן, אי ספיקת כליות או כבד, סוכרת, תת פעילות של בלוטת התריס, מצב לאחר ניתוח או טראומה גופנית, שתיית אלכוהול ופעילות גופנית קיצונית25.
כמו כן ידוע על תרופות מסוימות המגבירות את הסיכון ובעיקר אלו המשפיעות על פעילות המערכת P450 (טבלה 2)27,25,5.
עליות קלות ברמת ה-CK בדם, עד פי חמישה מהנורמה, הן שכיחות ואינן מעידות בהכרח על נזק שרירי, כל עוד אין סימפטומים שריריים.
תופעה נוספת שנחשבת כפחות משמעותית מבחינה רפואית, אך משום מה מעוררת חרדה בקרב המטופלים הפוטנציאלים, היא הפגיעה הכבדית28,25. ברוב המקרים מדובר בעלייה קלה וא-תסמינית ברמת הטרנסאמינזות בדם, ולא ברור באיזו מידה שינוי ביוכימי זה עלול להוביל לנזק כבדי בלתי הפיך. למרות זאת, מקובל לעקוב אחרי תפקודי הכבד באופן תקופתי ולבצע שינוי בטיפול (הפחתת מינון או החלפה לתרופה אחרת) במידה שרמת הטרנסאמינזות עולה מעל פי שלושה מהנורמה. צריך להביא בחשבון שחלק ניכר מהמטופלים בדיסליפידמיה סובלים מבעיות מטבוליות המלוות באגירת שומן בכבד ("כבד שומני") המתבטא בעלייה ברמת ה-transaminase alanine)
SGPT ALT,) בדם. מצב זה אינו מהווה הוריית נגד לטיפול בסטטין ואולי אפילו מפחית את הצטברות השומן בכבד.
תופעות לוואי שכיחות פחות שאינן גורמות בדרך כלל לנזק בריאותי הן בעיות במערכת העיכול, כאבי ראש, קשיי שינה וירידה בריכוז. יש דיווחים נדירים על התפתחות נוירופתיה פריפרית בקרב מטופלי סטטינים, אך הקשר הנסיבתי עם התרופה עדיין דורש הוכחה.
התוויות קליניות
כפי שכבר צויין, הניסיון המחקרי הנרחב עם סטטינים מראה שניתן להפחית את שכיחות התחלואה והתמותה ממחלות קרדיווסקולריות בכשליש ברוב האוכלוסיות שבהן קיים סיכון מוגבר, ללא הבדל מין, גיל או רמת כולסטרול התחלתית. סביר להניח שתרופות אלו יעילות במידה דומה גם בקרב אוכלוסיה ללא כל גורם סיכון לטרשת עורקים, אם כי היפותזה זו טרם נבדקה במחקר קליני גדול. השיקול העיקרי בהחלטה האם להמליץ על טיפול בסטטין הוא זה של עלות-תועלת
(cost-benefit), כאשר המושג "תועלת" נבחן במושגים של ירידה אבסולוטית בסיכון והמושג "עלות" נבחן בהיבטים מעבר לעלות הכספית, כגון: הנכונות לקחת תרופה לכל החיים, צורך בבדיקות מעקב סדירות וסיכון לתופעות לוואי. רוב קווי ההנחיה (guidelines) ממליצים על טיפול בסטטין בכל החולים במחלה קרדיווסקולרית (מניעה שניונית), בכל חולי הסוכרת, או כאשר הסיכון המחושב לאירוע קרדיווסקולרי עולה על 20 אחוז במשך עשר השנים הקרובות לפי נוסחת פרמינגהם, או מעל חמישה אחוזים תמותה לפי נוסחת ה-SCORE האירופאי (מניעה ראשונית)19,20.
יחד עם זאת, אין סיבה למנוע טיפול מאנשים עם סיכון מחושב נמוך יותר בנוכחות גורמי סיכון שאינם נכללים בנוסחאות (כגון סיפור משפחתי של מחלה קרדיווסקולרית בגיל צעיר), בנוכחות הדמיה של טרשת עורקים סמויה (כגון דופלקס של עורקי התרדמה) או כאשר המטופל מביע רצון לקבל טיפול בסטטין לאחר ששקל את יתרונותיו ואת חסרונותיו.
לסיכום, מדובר בקבוצת תרופות ששינתה באופן מהפכני את יכולתנו להפחית את התחלואה והתמותה הקרדיווסקולרית. שימוש מושכל בתרופות אלו מלווה ביחסי עלות-תועלת מצוינים וחובה על מערכת הבריאות להגביר את השימוש בהן בקרב אותן אוכלוסיות שיכולות להרוויח מיתרונן המוכח.
פרופ' יעקב הנקין, המחלקה לקרדיולוגיה, בית החולים סורוקה, אוניברסיטת בן גוריון, באר שבע |