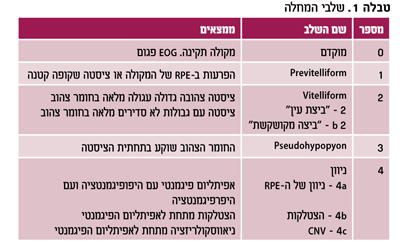
מחלה זו תוארה לראשונה על ידי Best בשנת 19051 ומאז נקראה בשורה ארוכה של שמות שונים. השמות השכיחים יותר הם מחלת Best או BVMD (Best Vitelliform macular dystrophy). המחלה היא נדירה יחסית אך בשנים האחרונות עלתה לתודעה נרחבת בציבור במדינת ישראל, הודות לעמותת "לראות" שמטרתה הרחבת המידע והמחקר על מחלות עיניים מולדות.
מחלת בסט מאופיינת על ידי מספר ממצאים. הבולט בהם הוא ממצא במקולה ונראה "כחלמון של ביצה", ממצא הנראה מפחיד, אך הבודק לעתים מופתע כשהוא מוצא כי חדות הראייה טובה. המחלה מולדת ומועברת על ידי מוטציה אוטוזומלית דומיננטית בגן BEST1 (ראו להלן). המחלה מתקדמת בהדרגה וחדות הראייה יכולה להיפגע בהמשך החיים. ממצא אלקטרו פיזיולוגי אופייני למחלה הוא שה-EOG ירוד. המחלה מתוארת בפירוט בספר של פרופ' מרין על מחלות תורשתיות של העין2.
הממצאים הקליניים
הממצאים הקליניים משתנים בהתאם לגיל ובהתאם למוטציה הגנטית הספציפית. התפתחות אופיינית של המחלה היא מעבר בין השלבים השונים של המחלה, כמתואר בטבלה מס' 1.
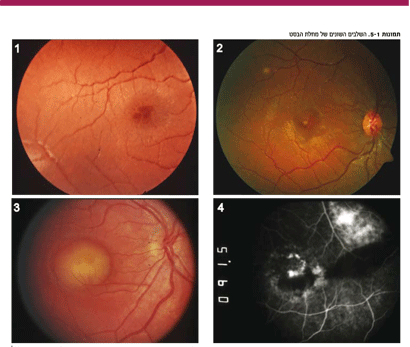
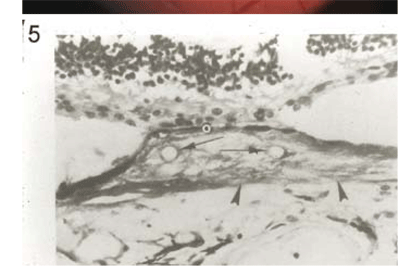
למרות שהמחלה מולדת, ברוב המקרים לא רואים כל ממצא במקולה עד גיל ילדות מוקדמת. היא בדרך כלל מתגלה בגיל שבין שלוש שנים ו-15 שנה, ולרוב סביב גיל שש שנים. בשלב ראשון של המחלה אופייני לראות שינויים מועטים באפיתליום הפיגמנטי או לראות ציסטה קטנה שקופה, כמו שרואים ב-CME (cystoid macular edema) (תמונה מס' 1). בהמשך, מופיעים השינויים האופייניים ביותר של ציסטה המלאה בחומר צהוב (תמונות מס' 2, 3). שקיעתו של החומר הצהוב כלפי מטה גורמת בשלב הבא לתופעה הנראית כמו היפופיון בלשכה הקדמית. בדרך כלל רואים ציסטה צהובה אחת בלבד, אך לפעמים יש ציסטות אחדות (תמונה מס' 4). בשלב הניוון, ניתן למצוא הצטלקות וניאווסקולריזציה (תמונה מס' 5).
כאמור, הבדיקה המאשרת את קיום המחלה היא בדיקת EOG. ברב המעבדות בישראל, הבדיקה הזאת נחשבת לתקינה כשהיחס בין התגובה החשמלית באור חלקי והתגובה בחושך (Arden ratio) הוא 1.8 או יותר. במקרים של מחלת בסט, נמצא יחס של 1.55 או פחות.
שורה של שאלות לגבי המחלה נותרה עדיין בלתי פתורה או פתורה חלקית. Cavender3 ניסח את שלוש השאלות החשובות לגבי המחלה: מה הוא החומר הצהוב? איפה הוא נמצא? כיצד הוא נוצר? עד היום אין תשובות ברורות לגבי שאלות אלו.
פתולוגיה
המחקר של המחלה התקדם מאוד מאז זיהוי הגן האחראי על המחלה והחלבון המיוצר על ידי הגן נקרא bestrophin-1. החומר העיקרי המצטבר במחלה הוא ליפופוסצין (lipofuscin), או ליתר דיוק, הצטברות אחד המרכיבים שלו הנקרא 4A2E. החומר מצטבר בתאים של האפיתליום הפיגמנטי ומאוחר יותר גם בחלל הבין-תאי באזור. ייתכן שבשלב מסוים נפגעת הפגוציטוזה של הסגמנט הדיסטלי של הפוטורצפטורים. כך נפגע התפקוד הן של הפוטורצפטורים במקולה והן של האפיתליום הפיגמנטי. מקובל, אם כן, כי המחלה נגרמת בגלל ביטוי לא תקין של החלבון bestrophin-1 באפיתליום הפיגמנטי, הגורם לתפקוד לקוי של ה-5RPE, אך פעילותו המדויקת של החלבון עדיין נתונה לוויכוח6,10.
טיפול
אין טיפול ידוע למחלה עצמה. לעומת זאת, חייבים לטפל בסיבוכים המופיעים בשכיחות לא קטנה במחלת ה-BVMD.
במקרים של בצקת במקולה ניתן לטפל על ידי Diamox במתן פומי7 או על ידי טיפות Trusopt לעין ניאו-וסקולריזציה (CNV) יכולה להופיע אפילו בגיל צעיר במחלה זאת והטיפול צריך להיות כמו בכל המקרים של CNV. טיפול יעיל ניתן במחלה על ידי לייזר PDT (photodynamic therapy)8, ולאחרונה גם על ידי זריקות 9Avastin. החוקרים של המחלה די אופטימיים לגבי האפשרות שהמחקרים הבסיסיים יובילו לטיפול ישיר בחלבון המוטנטי או בפגיעה אותה הוא יוצר10.
הגנטיקה של מחלת בסט
המחקר של מחלת הבסט התחיל כסיפור גנטי פשוט על גן אחד (BEST1 או בשמו הקודם VMD2) הגורם למחלה אחת (מחלת בסט), באופן תורשה אחד (אוטוזומלי דומיננטי). אולם, ממצאים שפורסמו בשנים האחרונות וכאלה הנחקרים כיום מעידים כי המצב מורכב הרבה יותר וכי הגן הגורם למחלת הבסט מעורב במחלות עיניים נוספות בדרכי תורשה מגוונות. הדינמיקה של המחקר בתחום זה מעידה על ממצאים נוספים וחדשות נוספות שיזרמו לעיתונות המדעית בשנים הקרובות, תוך תקווה שיובילו גם למציאת מזור למגוון החולים הסובלים ממחלות חשוכות מרפא אלו.
דרך ההורשה של מחלת הבסט - במשפחות רבות ובהן חולים הסובלים ממחלת הבסט, דרך ההורשה היא אוטוזומלית דומיננטית. במילים אחרות, ההורשה של המחלה אינה אחוזה למין (לכן נשים וגברים יכולים לחלות במחלה) והמחלה מורשת מהורה חולה למחצית מילדיו בממוצע. אולם, עוד בטרם התגלה הגן הגורם למחלת הבסט, ברור היה כי בחלק מהמשפחות ההורשה מורכבת יותר והוגדרה כהורשה אוטוזומלית דומיננטית עם חדירות חלקית, כיוון שלעתים גם הורים שאינם חולים (אם כי למרביתם נמצא שה-EOG אינו תקין) הורישו לילדיהם את המחלה. מחקר על מחלת הבסט, שמתבצע במחלקת עיניים בבית החולים הדסה ע"כ, הראה לאחרונה כי המחלה מורשת גם בהורשה אוטוזומלית רצסיבית, שבה לזוג הורים בריאים ללא רקע של המחלה במשפחתם, כרבע מהילדים בממוצע יחלו במחלה.
הגן הגורם למחלת הבסט - בידוד הגן הגורם למחלה התאפשר בעיקר עקב איתור משפחה שבדית גדולה ובה מידע על הורשת המחלה לאורך 12 דורות ודווח על יותר מ-250 בני משפחה החולים במחלת בסט11. תוך שימוש בשיטות תאחיזה גנטיות, מופה הגן בתחילת שנות ה-90 לאזור מסוים בכרומוזום 11 באדם, והגן הגורם למחלה אותר בסופו של דבר ב-121998,13. הגן נקרא בתחילה VMD2 אך שמו הרשמי שונה במהלך השנים ל-BEST1. הגן BEST1 הוא גן ממוצע בגודלו ומקודד לחלבון הנקרא בסטרופין-1 (bestrophin-1) הממוקם בעיקר בממברנה הבזולטראלית (basolateral plasma membrane) בתאי האפיתל של רשתית העין (RPE - Retinal Pigment Epithelium)14.
בעקבות גילוי הגן, נמצאו מוטציות בגן זה בכמעט כל החולים במחלת בסט שנבדקו ולהם היסטוריה משפחתית של המחלה (זה המקום לציין כי השיטות הקיימות היום מאפשרות איתור של אחוז גבוה מהמוטציות בגן מסוים, אך לא את כל המוטציות). עד היום אותרו יותר מ-100 מוטציות בגן BEST1 הגורמות למחלת הבסט (התוצאות נסקרו בהרחבה במאמר מספר 15). המוטציות שגורמות למחלת הבסט הן מסוג החלפת חומצה אמינית (missense) והחולים הם הטרוזיגוטים למוטציות אלו. כלומר, החולים נושאים עותק אחד תקין של הגן BEST1 ועותק אחד שאינו תקין. המוטציות מתרכזות בדרך כלל באזורים החשובים ביותר לתפקוד החלבון ובמקרים רבים נמצאו מוטציות שונות המשפיעות על אותה חומצה אמינית וגורמות למחלה. יותר מ-60 אחוז מהמוטציות הן "פרטיות" ונמצאו במשפחה אחת בלבד. גם במחקר שבוצע בארץ נמצא כי בכל משפחה ובה חולים במחלת בסט יש מוטציה אחרת הגורמת למחלה. מוטציות מסוימות נמצאו נפוצות יחסית במדינות מסוימות.
מחלות נוספות הנגרמות עקב מוטציות בגן BEST1 - בשנים האחרונות התברר כי מחלות עיניים נוספות ומגוונות נגרמות עקב מוטציות בגן זה. המחלה הדומה ביותר באופייה לבסט היא AFVD adult-onset foveomacular) vitelliform dystrophy) ובכ-25 אחוז מהמקרים נמצא כי BEST1 הוא הגורם למחלה בצורת הורשה דומיננטית16. דיווח מפתיע הראה כי מוטציות מסוימות בגן זה גורמות למחלה דומיננטית אחרת עם הפרעה בהתפתחות העין (כולל ננופתלמוס, מיקרורורנה, גלאוקומה וקטרקט) הנקראת ADVIRC (AD vitreo-retino-choroidopathy)17. לאחרונה התברר כי BEST1 גורם גם למחלת ניוון הרשתית התורשתית הנפוצה ביותר, רטיניטיס פיגמנטוזה (retinitis pigmentosa), הן באופן הורשה דומיננטי והן רצסיבי18. הורשה רצסיבית של מוטציות בגן BEST1 דווחה גם במחלת ניוון רשתית נוספת, ARB autosomal recessive) bestrophinopathy)19.
תפקודו המשוער של החלבון בסטרופין-1
BEST1 שייך למשפחה של גנים הכוללת ארבעה גנים בעלי דמיון ברצף. גנים אלה מקודדים לחלבונים שלגבי תפקידם רב הנסתר על הגלוי. בסטרופין-1 מכיל בין ארבעה לשישה אזורים חוצי-ממברנה, יוצר דימרים וממוקם בממברנת התא של תאי ה-14RPE, אך יש עדויות למיקום תוך-תאי6. החלבון נחשב כרב-תפקודי (multifunctional) וקיים ויכוח בספרות המדעית לגבי תפקודיו השונים: תעלת כלור (Cl-) המשופעלת על ידי ריכוז הסידן (Ca++) התוך-תאי, תעלת ביקרבונט (HCO3-) ו/או מעכב תעלות סידן תוך-תאיות תלויות מתח (intracellular voltage-dependent Ca2 + channels). כמו כן, מוטציות בגן הגורמות למחלה התפתחותית של העין מצביעות על מעורבותו בתהליך זה.
קשר גנוטיפ-פנוטיפ במחלת הבסט
רוב המוטציות (יותר מ-90 אחוז) הגורמות למחלת הבסט הן מסוג missense וגורמות לביטוי של חלבון שבו יש החלפה של חומצה אמינית מסוימת. מידע מעודכן על מוטציות אלו ניתן למצוא באתר:
http://www-huge.uni-regensburg.de/VMD2_database
מרבית המוטציות פוגעות באזור ה-N טרמינלי של החלבון שהינו שמור בין מינים. החלק ה-C טרמינלי, לעומת זאת, מראה שוני גדול בין חלבוני בסטרופין-1 במינים שונים. החלבונים המיוצרים על ידי גנים המכילים מוטציות אלו מוצאים, ככל הנראה, את דרכם אל ממברנת התא6. מבחני תפקוד
in-vitro בוצעו לחלק מהמוטציות ובהם נבדקה השפעת המוטציה על תפקוד החלבון כתעלת כלור.
ראוי לציין כי הקשר בין תוצאות מחקרים אלו לבין ההשפעה האמיתית של מוטציות אלו על תפקוד תאי ה-RPE אינו ברורה כיוון שהחלבון ממלא תפקידים אחרים שאינם נבדקים ומכיוון שבדיקת המוטציות אינה מתבצעת בסביבה הרגילה שבה מתפקד בסטרופין-1. מחקרים אלה מראים כי ברוב המקרים המוטציות פועלות במנגנון דומיננטי-שלילי. דהיינו, החלבון המוטנטי לא רק שאינו מתפקד כראוי אלא אף מפריע לפעילות החלבון שנוצר מהאלל התקין (החולים הינם הטרוזיגוטים למוטציה - משמע יש להם עותק אחד תקין ועותק אחד שאינו תקין של הגן BEST1).
תוצאות אלו אינן מסוגלות להסביר את השונות הגבוהה שנצפית במהלך המחלה אצל חולי בסט, אפילו אלה השייכים לאותה משפחה ונושאים אותה המוטציה. כפי שנאמר לעיל, המחלה לעתים מורשת כמחלה דומיננטית עם חדירות חלקית ואין כיום שום מידע שיצביע על הגורם המגן מפני המחלה באנשים הנושאים מוטציה הגורמת לבסט אך אינם מפתחים את המחלה.
חיות-מודל המשמשות להבנת תפקודו של בסטרופין-1
בדומה למחלות מקולריות אחרות, כגון מחלת סטרגרדט או ניוון מקולרי גילי
(age-related macular degeneration), גם במחלת בסט יש קושי רב באיתור מודל טוב בחיות, המחקה את מהלך המחלה בבני אדם. הסיבה לכך היא ברורה: העדר אזור מקולרי במרבית חיות המעבדה ובכלל היונקים שאינם פרימאטים. מורכבות האזור המקולרי בכלל, והפובאה בפרט, מחייבת קיומם של תהליכים התפתחותיים ותפקודיים שהם ייחודיים לאזור זה של הרשתית ואינם מתרחשים ברשתית חסרת פובאה (כגון רשתית העכבר).
בנוסף, האזור המקולרי מראה רגישות גדולה יחסית לתהליכים בלתי תקינים בקשר שבין ה-RPE לפוטורצפטורים, ולכן האזור המקולרי הוא היחיד או העיקרי שנפגע בחלק ממחלות הרשתית. יש להוסיף לכך את רמת ההתאמה הנמוכה יחסית בין רצפי החלבון לבסטרופין-1 באדם ובעכבר (63 אחוז מהחומצות האמיניות הן זהות), דבר העשוי להצביע על הבדל בתפקודי החלבונים המיוצרים על ידי גנים אלה.
עכברים שבהם הוחסר (knock-out mice) הגן BEST1 אינם מראים את הסימנים הקליניים האופייניים לחולי מחלת הבסט. עכברים אלה הם בעלי רשתית תקינה מבחינה היסטולוגית (עד גיל 14 חודשים) ,ERG תקין וללא בעיות ראייה20.
כמו כן, בעכברים אלה לא נעלמת תגובת ה-ERG שמקורה בתאי ה-RPE ואין פגיעה בהעברת יוני כלור כתלות בריכוז הסידן. עכברים שבהם הוחלף הגן האנדוגני עם גן המכיל מוטציה שגורמת באדם למחלת בסט (knock-in mice) מראים מספר מאפיינים בעלי דמיון למחלת בסט. לעומת זאת, חולדות המבטאות ביתר מוטציות הגורמות למחלת הבסט באדם, לא מפתחות את תסמיני המחלה - אין הצטברות ליפופוסקין וקרקעית העין נשארת תקינה21. מוטציות שהתרחשו באופן טבעי בגן BEST1 בכלבים גורמות למחלת רשתית הנקראת CMR (canine multifocal retinopathy) בהורשה רצסיבית ולה מספר מאפיינים משותפים עם מחלת הבסט. תוצאות אלו מצביעות על הקושי באיתור מודל אמין המשקף את מחלת הבסט ויאפשר הבנת המנגנונים הגורמים לה.
לסיכום, מחלת בסט היא מחלה תורשתית נדירה יחסית הכלולה במחלות מולדות המתבטאות רק בתקופות מאוחרות יותר בחיים. למרות הידע הנרחב שיש לנו לגבי המחלה, כגון הגן שזוהה, המוטציות הרבות שנמצאו בגן, הפתולוגיה של המחלה הידועה באופן חלקי והאישור של קיום המחלה המתקבל מבדיקת EOG, אנו עדיין חסרים מידע בסיסי וחשוב של המחלה. אנו עדיין לא יודעים כיצד ה-EOG משתנה במחלה הזאת. הטיפול היחיד שקיים בשלב זה הוא טיפול בסיבוכי המחלה, כגון בכלי הדם, אך טיפול בשינויים התאיים והביוכימיים עדיין לא קיים.
פרופ' שאול מרין, ד"ר דרור שרון, מחלקת עיניים, בית החולים האוניברסיטאי הדסה עין כרם והאוניברסיטה העברית, ירושלים