טרשת עורקים מהווה את הסיבה העיקרית למוות ותחלואה בעולם המערבי. גורמי הסיכון העיקריים לטרשת עורקים הם סוכרת, עישון, יתר לחץ דם ויתר שומנים בדם.
יתר כולסטרול הוא אחד מגורמי הסיכון העיקריים לטרשת עורקים. טרשת יכולה להופיע בכל מערכת בגוף, אך מיקומה בעורקי הלב והמוח מהווה סיבה לתמותה ולתחלואה רבה.
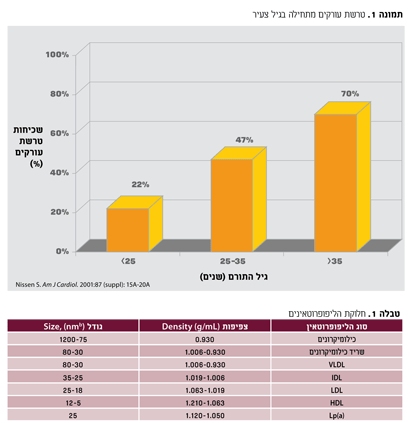
הכולסטרול מתבטא בדם בצורה של חלקיקים הנקראים ליפופרוטאינים. חלקיקים אלה מורכבים משומנים שונים, בנוסף לכולסטרול, חלבונים ומרכיבים אחרים.
בהתאם לאלמנטים השונים היוצרים את החלקיקים ובהתאם לצפיפותם וגודלם
(density), מקובל לחלק את הליפופרוטאינים למספר קבוצות (טבלה 1).
ה-Low density lipoprotein-LDL או ליפופרוטאין בעל צפיפות נמוכה, הוא האחראי להובלת הכולסטרול מהכבד לרקמות. החלבון המרכיב את ה-LDL נקרא Apo B-100. ה-LDL יכול לשקוע בעורקים ולגרום להתחלת התהליך של יצירת הפלאק הטרשתי.
כאמור, טרשת עורקים הינה הסיבה העיקרית למוות ותחלואה בעולם המערבי. מחלת לב וכלי דם (Cardiovascular disease-CVD) גורמת ליותר מקרי מוות מכל שאר המחלות ביחד.
המילה אטרוסקלרוזיס (Atherosclerosis) פירושה טרשת, הסתיידות או התקשות בעורקים. זה התהליך שבו חומרים שונים כולל שומנים, כולסטרול, חומרי פירוק מתאים, סידן וחומרים אחרים שוקעים ונבנים בחלק הפנימי של העורק (intima). התוצאה של תהליך זה הינה פלאק או רובד טרשתי. התהליך הטרשתי הינו תהליך כרוני וללא תסמינים, המתחיל כבר בגיל מוקדם ונמשך עד לשלבים מתקדמים בהם מגיעה החסימה העורקית למימדים קריטיים בגילאים מאוחרים יותר (תמונה 1).
הנגע הטרשתי שכיח במיוחד בהסתעפויות העורקים הגדולים ובלב. הוא מתחיל להתפתח בעקבות חדירת LDL לדפנות העורקים, מתחת לתאי האנדותל (החלל הסאב אנדותיאלי), התחמצנותו והצטברותו לתוך החלל.
בנוסף, קיימת הצטברות של טסיות דם, יסודות סיביים כגון פיברינוגן והפרשת גורמי גדילה, יחד עם התערבות של מערכת החיסון, בעיקר תאי דלקת ועוד. תהליכים אלה גורמים להתפתחות הנגע הטרשתי, דבר המוביל לחסימת העורקים ולירידה בזרימת הדם לרקמות. התוצאה הינה ירידה באספקת דם וחמצן לאיברים שונים. חוסר באספקת דם, או "איסכמיה", פוגע באיזורים השונים של מערכת הזרימה ולמגוון ביטויים קליניים בהתאם לאזור הנפגע (תמונה 2).
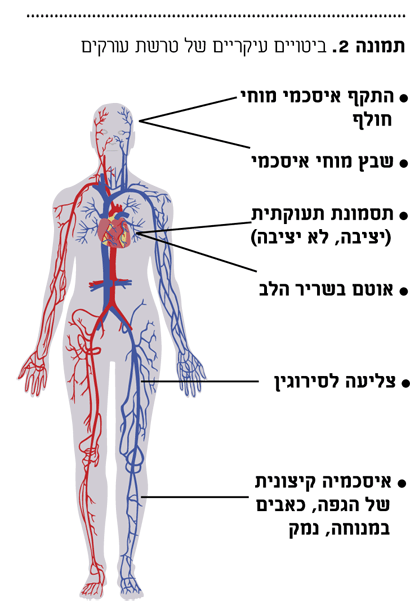
טרשת עורקים של העורקים הקורונרים גורמת לתסמונת תעוקתית (Anginal pectoris). הפגיעה במערכת העצבית המרכזית יכולה לגרום לארוע מוחי חולף transient ischemic attack) TIA) ופגיעה בעורקי הרגליים גורמת לצליעה לסירוגין (Intermittent Claudication). הנגע שנוצר עלול להפוך לבלתי יציב, לפגוע בעורקים הכליליים ולגרום לחסימתם ולאוטם בשריר הלב, או לאוטם או נמק באיזורים אחרים בהתאם לעורק הפגוע.
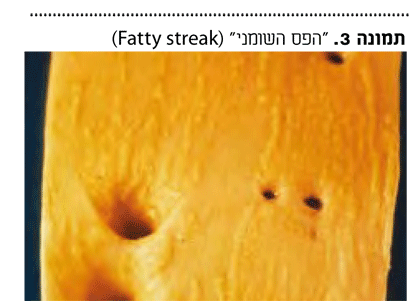
יצירת הרובד הטרשתי קשורה לשיווי משקל סבוך בין גורמים היכולים להגביר את יצירת התהליך הטרשתי, לבין מנגנונים אחרים הגורמים לדיכוי התהליך. טרשת עורקים מתחילה בגיל צעיר. ה"פס השומני" ("Fatty streak") (תמונה 3) הינו הביטוי הראשון של טרשת עורקים שמופיע כבר בילדות ובגיל ההתבגרות1. נגעים מוקדמים אלה נובעים ככל הנראה מעלייה בריכוז ליפופרוטאינים בחלק הפנימי של כלי הדם.
יצירת הרובד הטרשתי (Atheroma-atheroscerotic plaque) מתבצעת במספר שלבים (תמונה 4).
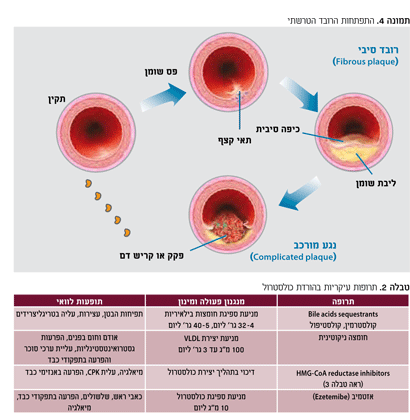
בשלב ראשון נוצר הפס השומני. ערכי כולסטרול גבוהים מאיצים הצטברות של LDL בשכבה הפנימית (intima) של העורקים. ה-LDL מתחבר למרכיבים אחרים מחוץ לתא, בעיקר proteoglycans. חשיבות מיוחדת בתהליך יצירת הרובד קשורה לתהליך של חמצון (oxidation) של ה-LDL. החמצון גורם להפיכתו של חלקיק זה ליותר אטרוגני ולהאצה של תהליך יצירת הרובד. נוצרת תגובה דלקתית מקומית הגורמת לגיוס של תאים שונים כמו כדוריות לבנות חד גרעיניות (מונוציטים) למקום הפגיע. תאים מונונוקלארים אלה הופכים עם כניסתם לדופן העורק למאקרופאגים. תאים אלה מסוגלים "לבלוע" (phagocytosis) שומנים ולהפוך לתאי קצף.
תאי שריר חלק עוברים מהשכבה האמצעית של העורק, מצטברים גם באינטימה ומהווים את עיקר הנפח של הנגע החדש. הרקמה הפיברוטית החדשה מכסה את המרכז העשיר בשומן ומצטברת מתחת לאנדוטליום בצורה של כיפה פיברוטית. התוצאה הינה יצירת הרובד הסיבי ("Fibrous plaque").
רובד זה יכול להישאר יציב או להפוך לרובד מורכב או בלתי יציב (Complicated plaque) שעלול להיקרע (להיבקע-rupture) ולגרום לפקקת, דבר המגביר את הפגיע בעורק ומחמיר את החסימה, את אספקת הדם והאיסכמיה. תוצאת תהליך זה היא אוטם או נמק של האיזור האיסכמי.
עבודות שונות שנעשו בשנים האחרונות, הראו שקיים קשר הדוק בין רמות כולסטרול ומחלת לב קורונרית. הורדת LDL הינה בעלת חשיבות ראשונית. טיפול להורדת כולסטרול גורם לשינוי בטרשת העורקים במספר היבטים2:
● הסיכון לארועים קליניים
● גודל הפלאק
● המרכיב התאי של הרובד הטרשתי
● המרכיבים הכימיים של הרובד
● הפעילות הביולוגית של הרובד הטרשתי בדגש על דלקת ומטבוליזם של כולסטרול
עבודות שונות הראו שטיפול בהורדת כולסטרול יכול לשנות את השלבים השונים של טרשת עורקים. הטיפול מבוסס על דיאטה מתאימה ועל טיפול תרופתי. הדיאטה צריכה להיות דלה בשומן רווי. בנוסף, מומלצים פעילות גופנית ושתייה לא מופרזת של יין אדום. יש לקחת בחשבון השפעה של תרופות מסויימות כמו חוסמי בטה וטיאזידים בהורדת HDL-C.
תרופות ספציפיות לטיפול להורדת כולסטרול (ראו טבלה 2)
Bile acids sequestrants
תרופות הקושרות חומצות ביליאריות ומונעות את ספיגתם. כתוצאה מכך חלה ירידה בערכי LDL-C ותתכן גם עלייה בטריגליצרידים. התרופה ניתנת כאבקה וצריך לדללה בנוזלים טרם הבליעה. תופעות הלוואי הן בדרך כלל גסטרואינטסטינליות וכוללות עצירות ותפיחות הבטן (bloating) (טבלה 2). התרופה לא נספגת ולכן היא בטוחה יחסית בילדים ובנשים בהריון.
חומצה ניקוטינית-ניאצין
תרופה זו הינה חלק ממערך ויטמין B. המדובר בתרופה ותיקה מאד, המונעת יצירת VLDL בכבד. כתוצאה מכך, היא מפחיתה את ערכי TG ו-LDL-C בפלזמה ומעלה במקביל את ערכי HDL-C. תופעת הלוואי העיקרית הינה אודם וחום בפנים (flushing), שלעיתים קרובות גורמים להפסקת לקיחת התרופה. עלייה קלה בטרנסמינזות מופיעה ב-15 אחוז מהמקרים. בנוסף יש הורית נגד ללקיחת התרופה אצל חולים עם כיב פפטי או רפלוקס. ערכי סוכר בצום יכולים להעלות תחת טיפול בניאצין.
היתרונות בלקיחת התרופה קשורים לעלייה בערכי HDL-C ולהשפעה משולבת על כולסטרול וטריגליצרידים. עקב תופעות הלוואי הרבות והבעייתיות בנטילת התרופה יש צורך במתן הדרגתי ומסודר שלה ובלימוד והדרכה של החולה בנטילת התרופה.
בשנים האחרונות פורסמו עבודות רבות המשקפות את הניסיון להתגבר על תופעות הלוואי הקשות של התרופה. התוצאה הינה הופעת אגוניסטים עם השפעות שונות מבחינת פוטנטיות ותופעות לוואי. הפיתוח לאחרונה של ה-(GPR109A)- niacin G-protein-coupled receptor HM74A מסביר את ההבדל שבין המנגנונים בהם הניאצין מפעיל את השפעותיו הטיפוליות לבין אלה האחראים על התופעות הלא רצויות. כתוצאה מכך, התאפשר פיתוח של תרופות חדשות עם פוטנציאל מוגבר בטיפול בהיפרליפידמיה3.
לאחורנה פותח תכשיר חדש, ER niacin (Niaspan), אשר גורם להופעה מופחתת של סומק. בנוסף, פותחו גם תכשירים כמו Laropiprant שהינו אנטגוניסט של הקולטן DP. הקולטן אחראי על הופעת הסומק, כתגובה להפרשת פרוסטגלנדין D2, לאחר מתן ניאצין. שילוב של ER niacin עם Laropiprant גורם לירידה ניכרת בהופעת סומק לאחר ניאצין4.
אזטימיב
תרופה זו מונעת ספיגה של כולסטרול. במינון של 10 מ"ג נמנעת ספיגה בשיעור של כ-60 אחוז. אזטימיב היא תרופה יחסית חלשה בהורדת כולסטרול והירידה ב-LDL-C היא בשיעור ממוצע של 18 אחוז. השימוש העיקרי הינו כתוספת לסטטינים. במקרה זה, ההשפעה של האזטימיב מתווספת להשפעה המתקבלת מהסטטין וכתוצאה מכך ניתן לתת מינונים יותר נמוכים של סטטין עם השפעה מוגברת. בנוסף, ניתן להשתמש בתרופה זו כאשר אין סבילות לסטטינים. תופעות הלוואי העיקריות הן כאבי ראש ושלשולים, אך בשנים האחרונות דווח גם על הפרעה בתפקודי כבד ואפילו על דלקת כבד ולעיתים גם כאבי שרירים.
סטטינים
הסטיטנים פועלים למניעת ייצור כולסטרול. הכולסטרול נוצר במסלול המבלונט (Mevalonate Pathway) מ- Acetyl-CoA דרך שלבים שונים. המעבר מ-HMG-CoA למבלונט נעשה בעזרת אנזים הנקרא HMG-CoA Reductase. פעילות אנזים זה מדוכאת על ידי הסטטינים (ראה תמונה 5). פעולת הסטטינים גורמת לעלייה בקולטנים ל-LDL-C בכבד וכתוצאה מכך לירידה בליפופרוטאין זה.
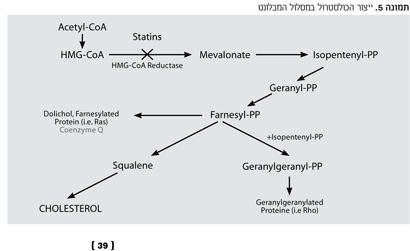
בנוסף להשפעתם בהורדת ערכי LDL-C, מקטינים הסטטינים בצורה מתונה את ערכי ה-TG ויכולים להעלות את ערכי ה-HDL-C ב-5-10 אחוז. תופעות הלוואי העיקריות קשורות לכאבי שרירים, הפרעות בעיכול, חולשה, עלייה ב-CPK והפרעה בתפקודי כבד. במקרים נדירים יכולות תרופות אלו לגרום למיופתיה קשה ורבדומיוליזיס. דלקת קשה בכבד הינה נדירה ביותר. בסך הכל נחשבת התרופה לבטוחה, יחסית.
הסטטינים העיקריים שפותחו בשנים האחרונות ונמצאים בשימוש מפורטים בטבלה 3. השימוש בסטטינים קיים כבר למעלה מ-20 שנה. הסטטין הראשון שהיה בשימוש הוא לובסטטין ("לובליפ").
הפוטנטיות של הסטטינים שונה. הרוסובסטטין והאטורבסטטין הם הפוטנטים יותר ולאחריהם הסטטינים האחרים.
הקשר בין ערכי כולסטרול ו-LDL לבין טרשת עורקים מבוסס, בין היתר, על שכיחות יתר של המצאות הפס השומני בעורקים של אנשים צעירים עם ערכי כולסטרול גבוהים; חולים עם היפרכולסטרולמיה משפחתית, מחלה גנטית שעוברת בתורשה באופן אוטוסומלי רססיבי גורמת למחלת לב קורונרית אצל גברים כבר בשנות ה-30 וה-40 לחייהם. חולים עם הצורה ההומוציגוטית של היפרכולסטרולמיה משפחתית חולים בטרשת עורקים מתקדמת כבר בזמן ההתבגרות ובדרך כלל לא שורדים מעבר לגיל 20. בניגוד לכך, ערכים נמוכים של LDL-cholesterol כמו במצב של חסר PCSK9, קשורים לירידה משמעותית בסיכון לטרשת עורקים ומחלת לב וכלי דם.
דרך נוספת, חדשה יותר, להורדת ערכי כולסטרול מבוססת על דיכוי האנזים MTP microsomal) triglyceride transfer protein) האחראי של העברת טריגליצרידים בכבד ליצירת VLDL ומכאן LDL. דיכוי האנזים גורם לחוסר יצירת VLDL ו-LDL בכבד. התרופה נוסתה במחקר על מספר בודד של חולים הומוציגוטים עם היפרכולסטרולמיה משפחתית וגרמה לירידה של כ-50 אחוז בערכי LDL אך השפעה חיובית זו לוותה בעלייה באנזימי כבד ובהצטברות שומן בכבד5.
טיפול להורדת כולסטרול ו-LDL גורם, כאמור, לירידה בהופעת מחלות קרדיווסקולריות. העבודות ההתחלתיות השתמשו בתרופות כגון ניאצין (niacin) או תרופות המרחיקות או מבודדות את חומצות הביליס (Bile acid sequestrants) או בפעילויות כירורגיות כמו כריתה חלקית של האילאום (Partial ileal bypass).
למרות שעבודות אלו הראו ירידה מתונה אבל משמעותית באירועים קרדיאלים, ההשפעה על ירידה בתמותה לא הייתה משכנעת - דבר שגרם לירידה בהתלהבות מטיפול אגרסיבי בהורדת כולסטרול.
גילוי תרופות יעילות יותר להורדת כולסטרול, דהיינו הסטטינים, הוביל למחקרים שונים שהראו את התועלת שבהורדת כולסטרול.
בשנים האחרונות נעשו מחקרים בחולים עם מחלת לב קורונרית, כמו המחקר הנקרא 64S, מחקר סקנדינבי שבדק השרדות בגברים עם היפרכולסטרולמיה תחת טיפול בסטטינים אשר הראה ירידה של 44 אחוז באירועים קורונרים וירידה בתמותה ב-30 אחוז בחולים שקבלו סימבסטטין, לעומת אלה שקיבלו תרופת דמה.
עבודות אחרות כמו ה-7CARE וה-8LIPID הראו ירידה בארועים קרדיאלים ומוות בגברים ונשים עם מחלת לב קורונרית שקיבלו פרבסטטין. עבודות אחרות כמו ה-2WOSCOPS וה-9AFCAPS/TexCAPS שעקבו אחר חולים שקבלו פרובסטטין ולובסטטין, בהתאמה, הראו ירידה משמעותית באירועים קרדיווסקולרים גם באנשים ללא מחלת לב סימפטומטית קודמת.
בשנים האחרונות נעשו גם עבודות שבהן חולים עם סוכרת או מחלה לבבית איסכמית אך עם עם ערכי כולסטרול ממוצעים ואפילו נמוכים יחסית, טופלו על ידי סטטינים במשך מספר שנים. הטיפול גרם לירידה משמעותית בתחלואה קורונרית ולירידה בתמותה הכללית.
טיפול בסטטינים גורם לעיכוב ביצירת הפלאק הטרשתי ותורם ליציבותו. ניתן לבדוק את העובי של השכבה הפנימית-אמצעית של עורק התרדמה ((Carotid artery intima-media thicknes-CIMT, בשיטות הדמייה שונות, כולל אולטרסאונד שבתוך כלי דם Intravascular ultrasound - IVUS)) או MRI. בעבודות שבהן נמדד בהדמיה באופן ישיר ה-CIMT, נראתה האטה ביצירת הפלאק והקטנת גודלו תחת הטיפול2. באחת העבודות הראשונות, מתן ניאצין + קולסטיפול במשך שנתיים גרם להקטנת ה-CIMT הנמדד באולטרסאונד10. בעבודות אחרות, שנעשו לאחרונה2 על ידי שימוש באולטרסאונד או ב-IVUS, גרם טיפול בסטטינים למשך 18 עד 24 חודשים להאטה בהתקדמות הפלאק הטרשתי בקשר ישיר עם הערכים החדשים של LDL שהתקבלו. ירידה בנפח האטרומה של 0.4 אחוזים התקבלה כאשר ה-LDL cholesterol ירד לפחות מ-87.5 מ"ג% וה-HDL עלה מעל 7.5 אחוזים.
לגבי השפעה על מרכיבי האטרומה, מספר עבודות שנעשו לאחרונה הראו שטיפול בסטטינים משנה את המבנה התאי של הרובד הטרשתי. טיפול שגרם לירידת ה-LDL לערך ממוצא של 90 מ"ג/דל הוריד את אחוז המאקרופגים והלימפוציטים בפלאק ל-57 אחוז ו-67 אחוז בהתאמה ובמקביל הוריד את המרכיב השומני והעלה את הקולגן בתוך האטרומה בצורה משמעותית2.
הזמן שצריך לחלוף מהתחלת הטיפול בסטטינים ועד לקבלת התוצאות הקליניות שתוארו קודם לכן יכול להיות קצר יחסית. בחולים שקבלו טיפול אינטנסיבי בסטטינים לאחר שחלו בתסמונת קורונרית חדה, נצפתה ירידה בסיכון לאירועים קלינים לאחר 4-6 חודשים2.
ההשפעה שבטיפול בתרופות להורדת כולסטרול נשארת גם לאחר תקופה ממושכת. הדבר הוכח בעבודות שונות עם סטטינים כמו ב-WOSCOPS
2 (West of Scotland Coronary Prevention Study) שבה לאחר הפסקת פרבסטטין בתום 5 שנים מתן התרופה, נמשכת הירידה בסיכון למשך כ-10 שנים לאחר ההפסקה. בדומה לכך, בעבודה אחרת, ישנה יותר, שימוש בניאצין למשך 5 שנים גרם לירידה בתמותה ב- 11 אחוז תשע שנים לאחר גמר המחקר11.

בעקבות עבודות אלו ורבות אחרות, פורסם בשנת 122001 ו-132002 הדו"ח השלישי של ה-NCEP עם ההנחיות החדשות לגילוי, הערכה וטיפול בערכי כולסטרול גבוהים במבוגרים. ההנחיות החדשות קובעות בהשוואה להנחיות הקודמות שפורסמו בשנת 1993, גישה יותר אגרסיבית בהורדת כולסטרול. מוכנסת לראשונה ההגדרה של "CHD equivalent" = "שווה ערך מחלת לב קורונרית" לגבי סוכרת ולגבי חולים בעלי סיכון גבוה מאד למאורע קרדיאלי.
במקרים אלה ובמקרים של טרשת עורקים פעילה, הערך האופטימלי המומלץ של LDL-C הינו > 100 מ"ג/דל.
בשנים האחורנות נעשו גם עבודות שהראו שהטיפול בסטטינים מונע אירועים קרדיווסקולרים לא רק בחולים שבהם ישנה הוריה ברורה למתן סטטינים על פי ההנחיות העדכניות אלא גם באלה עם ערכי LDL נמוכים יותר, שלא מהווים התווייה לטיפול. ה- Heart Protection Study) HPS) שכלל 20,536 חולים עם מחלת לב קרדיווסקולרית או סוכרת וערכי כולסטרול מעל 135 מ"ג% הראה שטיפול בסימבסטטין בחולים אלה למשך זמן ממוצא של 5 שנים, גרם לירידה באירועים קורונרים ולירידה בתמותה בצורה משמעותית, גם בקבוצה גדולה של חולים שאצלם ה-LDL-C ההתחלתי היה מתחת ל-100 מ"ג%14.
ה-ASCOT-LLA (The Anglo-Scandinavian Cardiac Outcomes Trial Lipid-Lowering Arm) בחולים היפרטנסיבים ומספר גורמי סיכון2
וה-Atorvastatin Diabetes Study) CARDS15 ) בחולים עם סוכרת מסוג 2 הראו תוצאות דומות תחת טיפול באטורבסטטין 10 מ"ג לעומת טיפול פלצבו. שני העבודות הסתיימו טרם זמנן, עקב הירידה הבולטת באירועים קרדיווסקולירם אצל החולים שקיבלו טיפול באטורבסטטין.
תוצאות מחקרים מהשנים האחרונות משנות עוד יותר את התפיסה שהייתה המקובלת עד לא מזמן, לגבי המצבים והערכים של LDL-C שבהם יש צורך במתן טיפול ומעלות את הסברה (המצריכה עדיין הוכחה סופית, לדעתנו), ש"כמה שיותר נמוך יותר טוב" ("The lower, the better.."). לדוגמה
ב-Treat to New Targets (TNT) trial16, חולים עם מחלת לב קורונרית ו-LDL פחות מ-130מ"ג% קבלו בצורה אקראית שני מינונים שונים של אטורבסטטין: 10 מ"ג או 80 מ"ג. בחולים שקיבלו 80 מ"ג חלה ירידה משמעותית של מאורעות קרדיווסקולרים לעומת אלה שקבלו מינון נמוך יותר.
בצורה דומה, בעבודה אחרת17, חולים עם תסמונת תעוקתית חדה וערכי LDL-C מתחת לנורמה המקובלת למתן טיפול, קיבלו בצורה אקראית אטורבסטטין 80 מ"ג או טיפול פחות אינטנסיבי בפרבסטטין 40 מ"ג ליממה. גם במקרה זה, הטיפול הנמרץ יותר באטורבסטטין גרם לירידה משמעותית באירועים קרדיווסקולרים בהשוואה לפרבסטטין. ה- LDL-C ירד ל-62 מ"ג% עם אטורבסטטין ול-95 מ"ג% בפרבסטטין. בהתבסס על כך, ההנחיות לטיפול בהיפרכולסטרולמיה ממליצות כיום על טיפול אפשרי להורדת LDL-C מתחת לערך של 70 מ"ג/דל אצל חולים עם סיכון גבוה מאד לטרשת עורקים18.
המרכיב הדלקתי בטרשת עורקים ידוע היטב ושימש כמטרת המחקר בעבודות רבות. עבודות אלו הוכיחו שקיים קשר בין הסממן של דלקת C-Reactive Protein) CRP) לבין ארועים קרדיווסקלורים. בדומה לירידה ב-LDL, ירידה בערכי CRP קשורה באופן ישיר לירידה באירועים קרדיווסקולרים.
עד כה, לא היה ידוע אם חולים עם CRP גבוה, בלבד (בנוכחות ערכי LDL תקינים) יכולים ליהנות מטיפול בסטטינים מבחינת הירידה באירועים קרדיווסקולרים. בשנת 2008 פורסמה עבודת ה-19JUPITER שבדקה שאלה זו: 17.802 נשים וגברים, ככל הנראה בריאים, קיבלו בצורה אקראית רוסובסטטין או תרופת דמה. לאחר תקופה של 1.9 שנים, בממוצע, הופסק המחקר בטרם הסתיים, עקב התוצאות שהתקבלו עד לאותו שלב. בזמן סיום המחקר חלה ירידה משמעות בערכי LDL ו-CRP אצל המטופלים שקבלו רוסובסטטין לעומת אלה שקבלו תרופת דמה. חשוב מכך, במטופלים שקבלו רוסובסטטין חלה ירידה ניכרת במטרות הראשוניות (Primary end points), ביניהן מוות, אוטם בשריר הלב ומאורע מוחי, לעומת המטופלים שקבלו תרופת דמה.
עבודה זו מחזקת את המסקנות שהתקבלו בעבודות קודמות ומצדיקה שימוש רחב יותר בסטטינים. התשובה לשאלה "האם הכולסטרול הוא האחראי לתמותה וסיבוכים מטרשת עורקים או שבבסיס הבעיה קיים תהליך דלקתי", לא לגמרי ברורה בשלב זה. שאלות נוספות שעולות ממחקר זה הן האם יש צורך לבדוק ערכי CRP באנשים בריאים והאם צריך לטפל באלה עם ערכי CRP מעל הנורמה.
הדרך עוד ארוכה. למרות שהטיפול בהיפרכולסטרולמיה התפתח בצורה מעודדת ומעוררת ציפיות, השאלות רבות והתשובות עדיין לפנינו.
ד"ר אריה מרקל, מנהל מחלקה פנימית א', בית חולים העמק, עפולה מקבוצת הכללית