|
טרשת העורקים היא מחלה שכיחה המהווה את סיבת המוות העיקרית בחברה המערבית1. העורקים הכליליים המספקים דם לשריר הלב נפגעים לעתים קרובות מטרשת העורקים וכתוצאה מכך נפגעת אספקת הדם לשריר הלב. הפגיעה עלולה להסתמן באופן הדרגתי כהופעה של מחושים בחזה בזמן מאמץ עקב היצרות ההולכת ומחמירה בעורק הכלילי או באופן פתאומי עקב חסימה חדה של עורק כלילי הגורמת לאוטם שריר הלב.
ניתוח או צנתור
ניתוח המעקפים נועד לשפר את אספקת הדם לשריר הלב על ידי יצירה מלאכותית של כלי דם עוקפים המחוברים לעורקים הכליליים מעבר לחסימה. ניתוחים אלה מאפשרים שיפור ניכר בתפקוד הלב ובתוחלת החיים של המטופל אך כרוכים בהרדמה כללית, פתיחה ניתוחית של בית החזה ותקופת החלמה ממושכת.
במשך השנים שלאחר הניתוח נחסמים בהדרגה המעקפים ולעתים קרובות יש צורך להפנות את החולים לניתוח חוזר או לטפל בחסימות הכליליות בצנתור. לפני כ-30 שנה פותחה גישה חלופית זעיר-פולשנית המאפשרת פתיחת החסימות בעורקים הכליליים בצנתור. במהלך הצנתור מוחדר הצנתר דרך עורקי הגפיים אל אבי העורקים ומשם אל העורקים הכליליים. פעולה זו מתבצעת בהרדמה מקומית ומאפשרת שחרור החולה לביתו כבר למחרת הפעולה ללא פגיעה באיכות החיים.
בסוף שנות ה-70 הוכח שניתן להרחיב היצרויות בעורקים הכליליים על ידי בלון. במהרה התבררו שתי המגבלות העיקריות של גישה זו, שכללו חסימות פתאומיות של העורקים מיד לאחר הצנתור, דבר שעלול לגרום לאוטם שריר הלב, וכן הופעת היצרויות חוזרות לאחר מספר שבועות או חודשים, תופעה שבדרך כלל אינה מסכנת את החולה אולם מחייבת הרחבה חוזרת של העורק או הפניה לניתוח מעקפים.
תומכנים שאינם מפרישי תרופה
בשנות ה-90 של המאה הקודמת פותחו התומכנים הכליליים המתכתיים ("סטנטים") הבנויים מרשת מתכתית המקופלת על גבי בלון. על ידי ניפוח הבלון בתוך ההיצרות הכלילית, מורחב התומכן ומושתל בעורק. התומכן תומך בדפנות העורק ומונע קריסת הרקמה אל תוך חלל הנהור העורקי. השתלת התומכנים בתוך חלל העורק המורחב צמצמה משמעותית את הסיכון לחסימה פתאומית בשעות הראשונות לאחר הפעולה ואף הקטינה את הסיכון להיצרות חוזרת מאוחרת2. אולם, המבנה המתכתי הטרומבוגני של התומכן עלול להוות מצע להיווצרות של קריש דם וחסימה של העורק, תופעה הגורמת לעתים קרובות לאוטם שריר הלב ולמוות3.
הסיכון לסיבוך זה ירד משמעותית לאחר הבנת הפתופיזיולוגיה של התפתחות הקריש והבנת החשיבות של טיפול נוגד טסיות משולב באספירין ותרופה ממשפחת התיאנופירידינים (כגון טיקלופידין וקלופידוגרל)4. כיום, הסיכון לחסימה טרומבוטית של התומכן תחת טיפול בנוגדי טסיות משולבים הוא פחות מאחוז אחד. על פי רוב צומחת שכבה חדשה של אנדותל בתוך מספר שבועות לאחר ההשתלה, מכסה את זרועות התומכן ומפרידה את המבנה המתכתי מזרם הדם. בשלב זה ניתן להפסיק את הטיפול בתיאנופירידין ללא סיכון.
הופעת התומכנים הכליליים והבנת החשיבות של טיפול יעיל בנוגדי טסיות בתקופה שלאחר ההשתלה הגדילו משמעותית את הבטיחות והיעילות של ההתערבויות הכליליות לעומת העידן של הרחבות בלון בלבד. עקב אכילס של הפעולות נותר הסיכון להתפתחות מאוחרת של היצרות חוזרת בעורק שטופל, המתרחשת לאחר כ-30 אחוז מההתערבויות הכליליות. תופעה זו נובעת משגשוג של תאי שריר חלק בדופן העורק, היוצרים מעין רקמה צלקתית החודרת אל תוך הנהור וגורמת לחסימתו.
ההסתברות להופעת היצרויות חוזרות תלויה במאפייני החולה, במאפייני ההיצרות שטופלה ובטכניקת ההרחבה עצמה. היצרויות חוזרות שכיחות יותר אצל חולים סוכרתיים, לאחר השתלת תומכנים ארוכים בעורקים צרים וכאשר התומכן לא הורחב בצורה מיטבית.
תומכנים מפרישי תרופה
כדי להתמודד עם בעיה זו פותחו תומכנים המפרישים תרופה המעכבת את תהליך היווצרות ההיצרות החוזרת. בתומכנים אלה מודבק פולימר על דפנות התומכן וממנו מופרשת תרופה המונעת שגשוג תאים. התומכנים מפרישי התרופה הקטינו בכ-80 אחוז את הסיכון היחסי להופעת היצרות חוזרת בעורק ואפשרו טיפול בעורקים עם טרשת מפושטת מאוד שבעבר חייבו הפניה לניתוח מעקפים. כתוצאה מכך גדל מאוד מספר הצנתורים הטיפוליים על חשבון מספר ניתוחי המעקפים.
במהלך השנים האחרונות התברר שבניגוד לתומכנים רגילים, מעוכבת צמיחת שכבת האנדותל לאחר השתלת תומכנים מפרישי תרופה. כתוצאה מכך חשוף המבנה הטרומבוגני של התומכן לזרם הדם למשך זמן רב יותר והסיכון לטרומבוזיס בתומכן אינו יורד לאחר שבועות ספורים5. טרומבוזיס בתומכנים מפרישי תרופה עלול להתרחש גם שנים לאחר הפעולה והסיכון המוערך הוא כ-0.6 אחוזים לשנה. הסיכון לטרומבוזיס מאוחר בתומכן מפריש תרופה תלוי במאפייני החולה, בעורק ובתומכן. בדומה לתופעת ההיצרויות החוזרות בתומכנים רגילים, הטרומבוזיס המאוחר בתומכנים מפרישי תרופה שכיח יותר אצל חולי סוכרת וכאשר הושתלו תומכנים ארוכים בעורקים צרים.
ההמלצה העדכנית היא לטפל בשילוב של אספירין ותיאנופירידין למשך שנה לפחות לאחר השתלת תומכן מפריש תרופה6. טיפול זה חושף את המטופל לסיכון מוגבר לדימום. במידה שהמטופל נזקק לאחר הצנתור לפעולה פולשנית אחרת כגון ניתוח ערמונית או קטרקט, אזי יש צורך להפסיק את הטיפול התרופתי וכתוצאה מכך קיים סיכון להופעת קריש דם בתומכן. לפיכך, חשוב לתחקר את המטופל ביסודיות טרם הצנתור לגבי נטייה לדמם ולברר האם מתוכננות פעולות פולשניות אחרות בעתיד שעלולות לחייב הפסקת הטיפול נוגד הטסיות המשולב. במצב זה עדיף להשתיל תומכן רגיל או להפנות את החולה לניתוח מעקפים.
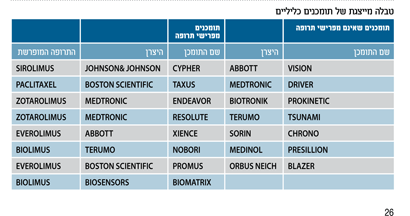
לאחר פיתוח הדור הראשון של התומכנים מפרישי התרופה (Cypher, Taxus) הבנויים מפלדה, פותח דור חדש של תומכנים גמישים יותר הבנויים מסגסוגת של קובלט וכרום (Xience, Promus, Resolute). למרות שנמצאו הבדלים מסוימים בשיעור ההיצרויות החוזרות בין תומכנים שונים המפרישים תרופה, לא הודגם הבדל מהותי בתוצאות הקליניות, ביעילות ובבטיחות8-7.
ההיצרויות החוזרות הפכו לנדירות מאוד, אולם החשש מטרומבוזיס מאוחר בתומכן נותר ממשי. הדגש בפיתוח תומכנים חדשים עבר להגדלת הבטיחות של הפעולה. מחקרים הצביעו על הפולימר כגורם מרכזי בעיכוב באנדותליזציה של התומכנים מפרישי התרופה. פותח תומכן עם פולימר מתכלה (Biomatrix) שנמצא כבעל יעילות ובטיחות שוות לתומכן מהדור הראשון9. גישה אחרת היא לרכז את הפולימר מפריש התרופה בחללים קטנים בדופן התומכן כדי להקטין את החשיפה של דופן העורק (Nevo). תומכנים אלה נחקרים בימים אלה10. במקביל מפותחים תומכנים נספגים המתוכננים כך שייעלמו בתוך מספר חודשים לאחר ההשתלה. היעילות והבטיחות של תומכנים אלה עדיין נחקרות.
לסיכום, הצנתורים הכליליים התקדמו באופן מעורר השתאות במהלך העשורים האחרונים. פעולות אלו הפכו לבטוחות וליעילות יותר ומאפשרות חלופה פחות פולשנית לטיפול במחלת לב כלילית לעומת ניתוח המעקפים. התומכנים מפרישי התרופה הפחיתו, מחד גיסא, באופן דרמטי את הסיכון להיצרויות חוזרות בעורק, אולם מאידך גיסא הם מחייבים טיפול ארוך טווח בנוגדי טסיות משולבים. לפיכך מתחייב שימוש מושכל בתומכנים השונים, תוך בדיקה מעמיקה של מאפייני החולה, יכולתו להתמיד בטיפול תרופתי לטווח ארוך, הסיכון להיצרות חוזרת במידה שיושתל תומכן רגיל והסיכון לדימום (עקב טיפול ממושך בנוגדי טסיות) במידה שיושתל תומכן מפריש תרופה. פיתוח תומכנים המבוססים על טכנולוגיות חדשניות עשוי למזער את הסיכון לטרומבוזיס מאוחר בעורק המטופל ולאפשר טיפול נוגד טסיות לטווח זמן קצר יותר.
חשוב לציין כי אין הוכחה מדעית חד משמעית שתומכן מפריש תרופה מסוג אחד עדיף על חברו. הטיפול הנכון מחייב להתאים כל תומכן למאפיינים הייחודיים של החולה והעורק המטופלים.
ד"ר רונן יפה, פרופ' בזיל לואיס, המערך הקרדיולוגי, המרכז הרפואי כרמל, חיפה |