הכאב העצבי מהווה את אחת מבעיות הכאב הקשות איתן מתמודדת הרפואה: הוא שונה באופיו מכאבים אחרים, בעל אופי קבוע ובנוסף קיימים אירועי כאב מתפרץ חזקים. איפיון זה גורם לבעיה במינון התרופתי. קשה לטפל בכאב מתפרץ מבלי לגרום לתופעות לוואי כמו ישנוניות. הכאב העצבי ברובו אינו ניתן לריפוי ולכן הטיפול בו הוא ארוך טווח ופוגע באיכות החיים של הסובלים ממנו. בשל העובדה שאין מענה אחיד לכל סוגי הכאב, חשוב לאבחנו במדויק. אפשרויות הטיפול מגוונות, מתרופות ועד התערבות כירורגית.
בשנה האחרונה נכנסו לסל התרופות תרופות חדשות לטיפול בכאב הנוירופטי וכמו כן השתנו התוויות השימוש בהן. התרופות הללו ייסקרו במאמר זה.
אפידמיולוגיה וקליניקה
כאב עצבי עשוי להתפתח בעקבות פגיעה או מחלה המערבת את מערכת העצבים הסומטו-סנסורית ההיקפית והמרכזית. בין הגורמים לכך ניתן למנות מחלות ניאופלסטיות, דלקתיות, מטבוליות ודגנרטיביות, טראומה ותגובות טוקסיות. תסמונות כאב עצבי היקפי שכיחות יותר מן המרכזיות וביניהן ניתן למנות את הנוירופתיה הסוכרתית הכואבת, נויראלגיה בתר - הרפטית
(Post herpetic neuralgia), כאב עצבי שלאחר התערבויות ניתוחיות (ובמיוחד ניתוחי דופן בית החזה, שד, כיס המרה ותיקוני בקע מפשעתי) ובעקבות חבלות בהן נפגעים עצבים כמו גם כאב גדם וכאב רפאים (Phantom pain) שלאחר קטיעת גפה.תסמונות הכאב העצבי המרכזי כוללות בין היתר כאב שלאחר אוטם מוחי (Central post stroke syndrome), לאחר נזק לחוט השדרה, במחלת הטרשת הנפוצה ועוד.
הכאב העצבי איננו נדיר. על פי הערכה, שכיחות הכאב העצבי עשויה להגיע עד ל- 7-5 אחוז מן האוכלוסייה המבוגרת. סקירות אפידמיולוגיות של תסמונות כאב שונות מורות כי 20-10 אחוז מחולי הסוכרת סובלים מנוירופתיה היקפית כואבת. בהנחה כי בישראל כ-400,000 חולי סוכרת, מדובר בכ-50,000 חולים הסובלים מנוירופתיה סוכרתית כואבת. רובם המכריע של קטועי הגפיים סובלים מכאב פנטום לפחות בסמוך לקטיעה ולמעלה מ-70 אחוז מן המנותחים העוברים ניתוחי דופן בית החזה או שד, סובלים מכאב עצבי באזור הניתוח לתקופות של שבועות עד שנים. בני הגיל המבוגר הלוקים בשלבקת חוגרת בשכיחות גבוה נוטים גם לפתח את הסיבוך הכאוב של תסמונת כאב בתר הרפטית (פוסט-הרפטיק נאורלגיה).
הכאב העצבי המאופיין עשוי במקרים רבים להיות עצמוני, קבוע או התקפי ובעל אופי "שורף", "הבזקי" או "מושך". חולים רבים סובלים מכאב המושרה ע"י גירוי שאינו מכאיב (אלודיניה) או מהעצמה ניכרת של הכאב בתגובה לגירוי מכאיב (היפראלגאזיה). במקביל, עלולים להתווסף ליקויי תחושה כמו רדימות או רחישויות (פרסטזיות), כל זאת בשילובים שונים הגורמים לכך שההסתמנות הקלינית עשויה להיות רב-גונית. כך, לדוגמא, עשוי חולה עם פגיעה חבלתית בעצב להתלונן על רדימות והבזקי כאב (אנסטזיה דולורוזה) בטריטוריית העצב הפגוע ואילו חולה אחר עם פגיעה דומה - על אלודיניה ורחישויות. יש לציין עוד כי לעיתים מופיע הכאב העצבי כסימן ראשון למחלה שעתידה להתפתח (לדוגמה נויראלגיה לפני הופעת התפרחת האופיינית לשלבקת חוגרת) ואילו במקרים אחרים יתפתח הכאב רק ימים או אף שבועות לאחר פגיעה מוכחת בעצב. מאפיין קליני נוסף הראוי לציון הינו נטיית הכאב העצבי שלא לחלוף עם הזמן ושלא להגיב או להגיב חלקית בלבד לטיפול במשככי כאב. לא אחת פוגע הכאב באופן משמעותי ביותר בכושר תפקודם ובאיכות חייהם של הסובלים ממנו.
מנגנוני הפגיעה בעצב
לא ניתן לפרט במסגרת זו את מגוון המנגנונים המוצעים כאחראים להתפתחות הכאב העצבי. עם זאת, ניתן בקצרה לומר כי בפגיעות בעצב היקפי מתפתחת גריות יתר (היפראקסיטביליות) שלו המושרית על ידי פעילות אקטופית באתר הפגיעה בעצב ובגנגליון השורש האחורי. נראה, כי לתעלות נתרן סידן ואחרות קיים חלק מרכזי בהתהוותה של גריות היתר ההיקפית. בנוסף, מתפתחת גריות יתר של תאי עצב תחושתיים בחוט השדרה ויתכן שגם באתרים גבוהים יותר במערכת העצבים המרכזית, המושרית על ידי גלוטמאט וכנראה שגם נוירוטרסמיטורים נוספים. יתכן, כי גם ליקויים בפעילות מערכת שיכוך הכאב המוחית האנדוגנית תורמים להתפתחות הכאב העצבי, אם כי מנגנונים אלה טרם הובהרו די הצורך.
מנגנון הכאב הנוירופתי
המנגנונים המובאים בזאת, מתארים את השינויים החלים במערכת העצבים בתגובה להרס ופגיעה בעצב הפריפרי. מנגנונים אלו מתרחשים בכל פגיעה עצבית פריפרית. הבנה של שינויים אלו מאפשרת לנו להבין את הרציונל בבחירת הטיפול לשיכוך כאב בכאב עצבי.
כתוצאה מפגיעה עצבית פריפרית, מתרחשים שינויים לאורך כל מערכת העצביים. נסקור כאן בקצרה את השינויים המהותיים שגורמים להתגברות הכאב.
1. השינוי הראשוני קורה באיזור הפגיעה בעצב בפריפריה. כתוצאה מהרס אקסונלי והרס של עטיפות המיאלין סביב האקסונים, נוצרים קשרים ברמה הפריפרית בין סיבי עצב שבדרך כלל היו מבודדים אחד מהשני. קישורים אלו מובילים ליצירת מעגלי גירוי בדומה למעגלים המתרחשים במיוקרדיום במצבי Re-entry. מעגלים אלה גורמים להפעלה עצמונית של סיבי העצב וזו אחת הסיבות לכאב המתפרץ, המאפיין את הכאב הנוירופתי. כמו כן, הקישור בין סיבים תחושתיים וסיבים מוליכי כאב גורם לכך שגירוי תחושתי יכול לדלג לסיב מוליך כאב.
2. שינוי נוסף קורה באיזור הפגיעה. נראה, כי מערכות עצבים מתפקדות לא רק כמערכות הולכת מידע אלא כמערכות אימוניות ואנדוקריניות. העצבים מפרישים לאיזור הפגיעה פקטורים אימונים NGF ,CGRP ,Substance P), גלוטמט וברדיקינין) המעוררים נדידה של נוגדנים ותאי חיסון. ההתעוררות החיסונית גורמת לירידה בסף ההפעלה של דופן העצב. ירידה זו גורמת לכך ששינויי המתח האוצילטורים הנורמליים במעטפת העצב חוצים את סף ההפעלה וגורמים להתפרצויות של הולכה עצמונית (כאב שהחולה מתאר כמתפרץ משום מקום ללא כל גירוי). בנוסף, הגירוי האימוני גורם, כנראה, להתקשרות בין תאי עצב מהמערכת האוטונומית לתאי העצב הסומטים.
3. בפגיעות בעצב היקפי מתפתחת גריות יתר (היפראקסיטביליות) שלו המושרית על ידי פעילות אקטופית באתר הפגיעה בעצב ובגנגליון השורש האחורי. נראה, כי לתעלות נתרן, סידן ואחרות קיים חלק מרכזי בהתהוותה של גריות היתר ההיקפית.
4. כאשר נוצר הרס מושלם של עטיפות העצב יחד עם ניתוק של האקסון, נוצרת גדילה מחדש של האקסונים שיוצרים מיני-נאורומות, שגם הן רגישות להפעלה ביתר ומייצרות גירוי כאב.
5. שני סוגי שינויים קורים באזור הכניסה לעמוד השידרה. שינוי אחד הוא קישורים חדשים בין המערכת האוטונומית החולפת בסמוך, ששולחת סיבים המתחברים לגוף תא העצב הנמצא ב-Dorsal root ganglion. כאשר מופרש אדרנלין לאזור מתאי עצב סימפטטים עולה רגישות ההולכה בעצב. השינוי השני הוא עלייה במספר תעלות הסידן על קרום תא העצב. העלייה מתורגמת לכניסת סידן מוגברת לתוך גוף התא ועל ידי כך שחרור של בועיות (ווסיקולות) המכילות חומרים מעוררים למרווח הסינפטי.
6. לאחר כניסתם של תאי העצב לקרן האחורית של עמוד השדרה, הם מתפזרים לתוך הלמינות השונות בהתאם לסוג המידע המועבר דרכם. כאשר יש מוות של האקסונים יש רה-אירגון של מיקום סיבי העצב בתוך חוט השדרה. גם תהליך זה תורם לתחושות הדיס-אסטטיות להולכה פגומה.
7. עירור יתר בתרגום הכאב נוצר במח עצמו. השינויים מורכבים לדיון במסגרת מאמר זה.
8. בכל מערכת בגוף החי, ישנה העצמה והתעוררות של המערכת בתחילת פעולה שהולכת ומתחזקת, אך במקביל מופעלות מערכות שיאפשרו את סיום הפעולה כדי שלא תימשך לעד. בהולכת מידע מהפריפריה למח ישנן מערכות עצב שיורדות מהמח, שתפקידן להפחית את ההולכה. בזמן פגיעה עצבית יש ירידה בהפעלתן של מערכות אלו, ולכן הגירוי הכואב מתמשך ולא פוסק.
הטיפול בכאב הנוירופתי
הטיפול התרופתי הפומי מורכב מטיפול תרופתי על ידי מספר משפחות של תרופות. שלוש קבוצות תרופות מהוות את אבני היסוד בטיפול בכאב העצבי והן התרופות נוגדות הפרכוס, התרופות נוגדות הדיכאון והאופיואידים.
משפחת נוגדי הכפיון
משמשת לטיפול בכאב עצבי שנים רבות. הסיבה לבחירה במשפחה זו היא כתוצאה מהבנה של המנגנונים היוצרים את הכאב הנוירופתי. המנגנונים של הפעלה עצמונית, מעגלי Re-entry וירידת סף ההפעלה (עלייה במתח הפנים של קרום העצב) משותפות לכאב העצבי ולאפילפסיה. לכן, תרופות המשפיעות על האחד ישפיעו גם על השני.
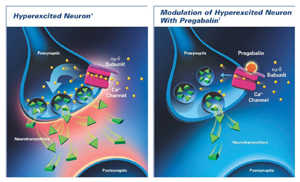
הליריקה (pregabalin) הנה תרופה חדשה אשר נבדקה ונמצאה יעילה ובטוחה במספר גדול של חולים עם נוירופתיה סוכרתית או בתר-הרפטית. התרופה פועלת על תעלות הסידן הספציפיות המופיעות בזמן כאב נוירופתי על ה-Dorsal root ganglion. התרופה נקשרת לתעלת הסידן לחלבון ה-α2-δ שמונע את מעבר הסידן בתעלה. עקב האפיניות הגבוהה שלה לחלבון זה והסלקטיביות הגדולה של התרופה, פרופיל תופעות הלוואי הוא קטן. כמו-כן, התרופה אינה עוברת מטבוליזם ידוע בגוף ומופרשת ב-99 אחוז דרך השתן. דבר זה גורם לכך ששיקולים כתפקוד כבדי והשפעה על תרופות אחרות, אינם משמעותיים. יש להקטין את מינון התרופה בחולים עם פגיעה כלייתית קשה, אך גם שם ניתן פשוט להקטין מינון ותדירות מתן מאחר והתרופה בצורתה האקטיבית תישאר בדם לאורך זמן. העלאת המינון למינון תראפויטי קלה ומהירה ביותר מכלל התרופות נוגדות הכפיון והדיכאון. מינונה נע בין 300-600 מ"ג ליממה בשתי מנות מחולקות. התאמת המינון מתבצעת תוך פרק זמן קצר. תופעות הלוואי דומות - בעיקר חוסר יציבות, עייפות, טשטוש, בצקות היקפיות ומדי פעם הפרעות במיקוד ראיה. מצד שני, התרופה עוזרת לשיפור איכות השינה של החולים, אשר בדרך כלל פגועה עקב הכאב.
הנוירונטין (gabapentine) נמצא יעיל בשיכוך כאב עצבי מסוגים שונים במספר רב של מחקרים. בחלק ממדינות המערב נחשב הנוירונטין לתרופת הבחירה לשיכוך כאב עצבי בשל היעילות הגבוהה ומיעוט יחסי של תופעות לוואי. מינון הנוירונטין נע בין 900 - 3,600 מ"ג ליממה בשלוש מנות מחולקות. העלאת המינון מתבצעת תוך ימים ספורים. עיקר תופעות הלוואי זהות לאלו של הליריקה אך מעט מוגברות עקב אפיניות נמוכה יותר לקולטנים העצביים. שתי התרופות נכנסו לאחרונה לסל התרופות כקו שני לטיפול בכאב עצבי.
הטגרטול (carbamazepine) יעיל במיוחד בהפחתת התקפי נויראלגיה טריגמינלית, אך כנראה שגם בכאבים עצביים נוספים. המינון ההתחלתי הינו 100 מ"ג פעמיים ביום ויש לעלות במינון בהדרגה בשל ריבוי תופעות הלוואי. המינון המומלץ הוא זה שמביא להקלת כאב ללא תופעות לוואי בלתי נסבלות וללא קשר לרמת התרופה בפלסמה. תופעות הלוואי רבות וכוללות הפרעות בשווי המשקל, ישנוניות, תפרחת על פני העור, הפרעות בתפקודי הכבד, יפונתרמיה, דיכוי מח העצם ועוד. יש, לפיכך, צורך לערוך בדיקת אלקטרוליטים, תפקודי כבד וספירת דם לפני תחילת הטיפול ואחת למספר חודשים בהמשך.
הלמיקטל (lamotrigine) הינה תרופה נוגדת פרכוס נוספת אשר נמצאה יעילה במספר סוגי כאב עצבי דוגמת נוירופתיה סוכרתית, נויראלגיה טריגמינלית, כאב סכיאטי ועוד. המינון האפקטיבי נא בין 200-400 מ"ג בשתי מנות מחולקות אולם יש להעלות את מינון התרופה בהדרגה, פעם בשבוע, החל מ-25 מ"ג ליום כדי למנוע תופעות לוואי ובמיוחד תפרחת, העלולה להתפתח לתגובת סטיסנס-ג'ונסון.
קבוצת התרופות נוגדות הדיכאון
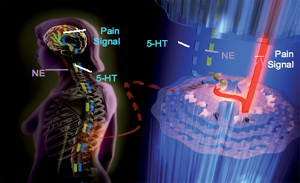
מנגנון פעולתן המשוער הינו הפעלת מערכות שיכוך כאב מוחיות וחיזוק פעולתם של המסלולים היורדים מהמוח לכיוון חוט השידרה ומדכאים הולכה במסלולי כאב לכיוון הפריפריה. הדבר נעשה באמצעות מניעת ספיגה חוזרת של סרוטונין ונוראדרנלין בסינאפסות מוחיות. יתכן, כי לתרופה מנגנוני שיכוך כאב נוסף באמצעות ייצוב מעטפות תא עצביות. השפעתן של התרופות הנ"ל על הכאב היא ישירה ואינה תלויה בהשפעתן על דיכאון. לרוב השפעתן על הכאב היא במינונים נמוכים מהמינונים הנדרשים לטיפול בדיכאון ומהירה יותר. חשוב לומר למטופל כי התרופה בה הוא מטופל משמשת גם לטיפול בדיכאון.
היבט הדיכאון עצמו הוא היבט חשוב בכאב. למעשה, הסבל הוא הגורם המפריע בכאב (הבדל שנראה סמנטי אך אינו כזה), והאספקט הנפשי של הכאב הוא החלק המשמעותי. כמו כן, כאב כרוני מוביל לדיכאון בחלק גדול מהמקרים ובמיוחד בקרב הסובלים מכאב עצבי. לכן יש תועלת כפולה בשימוש בתרופות נוגדות דיכאון לכאב.
קבוצת התרופות נוגדות הדיכאון כוללת מספר תת-קבוצות.
הקבוצה הוותיקה של תרופות בעלות המבנה התלת-טבעתי (טרי-ציקלי) נחקרה רבות ונמצאה יעילות בהפחתת סוגי כאב עצבי רבים, ללא קשר להשפעתה על דיכאון. התרופות מתת-קבוצה זו אינן בררניות ומשפיעות על חומרים מוחיים נוספים ולכן גם תופעות הלוואי שלהן יותר נרחבות.
אלטרול (amitriptyline) הינו "נציג" הקבוצה. הוא ניתן במינון התחלתי של 10-25 מ"ג. העלאת המינון חייבת להיות הדרגתית, כדי להפחית תופעות לוואי. חלק מן המטופלים מדווחים על הקלת כאב במינוני ביניים (50-75 מ"ג), אם כי לעיתים יש צורך להגיע ל-100-150 מ"ג ליממה ואף יותר במנה אחת בערב. הסיבה לכך היא שהתרופה גורמת לישנוניות וכך ניתן להשתמש בתופעות הלוואי כדי לעזור למטופל להירדם. תופעות הלוואי רבות וכוללות אפקטים של יובש בפה, עצירות, ישנוניות יתר, סחרחורת ועוד. יש להימנע משימוש בתרופה אצל חולים הסובלים מגלאוקומה מסוג זווית חדה, הגדלת הערמונית, הפרעות במערכת ההולכה בלב ולאחר אוטם חד בשריר הלב. תרופות נוספות מקבוצה זו הן דפרקסן (desipramine), אנפרניל (chlomipramine) ואחרות.
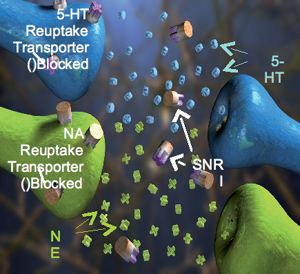
(SNRI (Serotonin and Norepinephrin reuptake Inhibitor היא הקבוצה השנייה המודרנית של תרופות נוגדות דיכאון, שנמצאה יעילה לטיפול בכאב עצבי. מאחר והחסימה יותר בררנית מאשר התרופות התלת-טבעתיות, פרופיל תופעות הלוואי שלהן נמוך יותר.
סימבלטה (duloxetine) נרשמה בארץ ואף הוכנסה לסל התרופות לאחר שנמצאה לה יעילות גבוהה בהפחתת כאב עצבי סוכרתי: ירידה ב- 50 אחוז ברמת הכאב, ב-50 אחוז מהמטופלים. התרופה משמשת כתרופה הראשונה לטיפול בכאב נוירופתי סוכרתי לאחר מיצוי הטיפול בתרופות הקו הראשון. התרופה חוסמת את ספיגת נוראדרנלין והסרוטונין באופן סלקטיבי ועל ידי כך מגבירה את הפעילות במסילות העצביות היורדות מהמח ומדכאות את הולכת הכאב מהפריפריה לכיוון המח. ניתן להתחיל עם מינון של 30 מ"ג לשבוע ואז להעלות את המינון ל-60 מ"ג ליום במנה אחת בערב. תופעות הלוואי העיקריות שנצפו היו בחילה, נמנום וסחרחורת. רוב תופעות הלוואי היו בדרגת חומרה קלה עד בינונית, נצפו בדרך כלל בתחילת הטיפול וחלפו עם המשך הטיפול.
נציג נוסף ממשפחה זו הוא האפקסור (Venlafaxine) אם כי לגביו ההוכחות ליעילות נמוכות יותר והוא אינו רשום לאבחנה של טיפול בכאב עצבי בישראל.
(SSRI (Selective Serotonin reuptake Inhibitor תת הקבוצה השלישית פועלת באופן סלקטיבי להעלאת מינון הסרוטונין במוח. תרופות אלה בטוחות יותר בשימוש בהשוואה לטרי-ציקליות אולם יעילותן כמשככי כאב עצבי ירודה בהתאם. מבין תרופות אלה, ניתן לציין את הסרוקסאט/ פאקסט
(paroxetine) הניתן במנה אחת בת 20-40 מ"ג מאחר ונמצא יעיל בהפחתת נוירופתיה סוכרתית כואבת במחקר בודד. זאת כנראה בשל העובדה כי השפעתן על הכאב נובעת בעיקר מהשפעתן על הדיכאון הנלווה.
תרופות ממשפחת האופיואידים כמורפין, אוקסיקודון ופנטניל יעילות ביותר להקלת כאב עצבי. מאחר ופרופיל תופעות הלוואי מהן גבוה יותר, בעיקר בגילאים המבוגרים, תרופות אלו מומלצות כקו שני לאחר כשלון התרופות שהוזכרו לעיל, או בשילוב עימן.
משחות חיצוניות על איזור הכאב יכולות לעזור עם פרופיל תופעות לוואי וסיכון נמוך במיוחד.
הזוסטריקס (capsaicin) משווק כמשחה למריחה על האיזור הכאוב בריכוזים שונים. עיקרון הפעולה הוא בכך שהחומר הפעיל זהה לחומר הפעיל בפלפל אדום. החומר נספג דרך העור ומרוקן את קצות העצבים מ-Substance P, שהוא החומר הגורם לתחושת השריפה ולהורדת סף הפעלת העצב. חסרונו של החומר הוא בכך שנוצרת צריבה חזקה בתחילת הטיפול, עד שמגיעים לשלב בו יש ריקון מוחלט של סיבי העצב.
מדבקות לידוקאין 5%. מדבקות אלה, המיוצרות בחו"ל ומיובאות ארצה, משמשות להרדמה מקומית של איזור הכאב. חסרונן במחירן הגבוה ובכך שישנה בעיה בכיסוי איזור נרחב.
עירויים תוך וורידים: במידה ונכשלנו בטיפול התרופתי דרך הפה, השלב הבא הוא מתן עירויי מגנזיום ולידוקאין במרפאות כאב. טיפולים אלה עוזרים להקלה של כל כאב על רקע עצבי. חסרונם בכך שהם מחייבים את החולים להגיע לטיפול במרפאה כפעמיים בחודש, למספר שעות בכל פעם.
לאחר מכן נשקול טיפולים חודרניים כגון הזרקות לעצבים, בייחוד במקרי מונו-נוירופתי ופלקסופטי. הסיבה לכך היא שבסוגי פגיעה אלה יש מטרה עצבית ברורה ולא פגיעה מפושטת. בדרך כלל אנו מזריקים שילוב של חומרי הרדמה מקומיים וסטרואידים, שעוזרים אבחנתית ותרפויטית.
השתלות של אלקטרודות לעמוד השדרה (Spinal cord stimulator) יכולות להועיל במקרים רבים של כאב עצבי לסוגיו, כולל פולי-נוירופתיה סוכרתית. ההשתלה הנעשית לעו"ש צווארי וטורקלי יכולה לתת כיסוי של גפיים עליונות ותחתונות (בהתאמה). מנגנון הפעולה אינו ברור לחלוטין, אך מורכב כנראה מפעולה משולבת של הפרשת חומרים מדכאי הולכה במסלולי כאב כאופיואידים אנדוגנים וחומרים דמויי GABA, הפרעה בהולכה העצבית וחסם פעילות סימפתטית, שגורם להרחבת כלי הדם בגפיים. הפעולה כלולה בסל הבריאות מזה כעשר שנים, ויעילותה הוכחה במחקרים רבים.
השימוש במשאבות המזליפות מורפין ותרופות אחרות ישירות לנוזל התוך שידרתי יעיל, אך אחוז הסיבוכים בהן גבוה.
לבסוף, לחולים שדבר לא הועיל להם, ניתן לבצע נתק עצבי בטכנולוגיות שונות. פעולה זו לא מבוצעת תדיר, עקב המורבידיות שהיא נושאת עימה.
לסיכום: הכאב העצבי לסוגיו שכיח וכרוך בסבל ניכר ובפגיעה קשה באיכות חייהם של חולים רבים. ההסתמנות הקלינית של כאב עצבי רחבה ושונה לעיתים מחולה לחולה. עקב כך, ובשל העובדה שהוא מגיב לטיפולים ספציפיים בלבד, יש חשיבות מרובה לאבחון מדויק. חוסר אבחון, מעבר לסבל הנורא, יכול לגרום גם לתחלואה קשה.
אין מענה אחיד ויעיל לכל צורות הכאב ולכן חשוב להכיר את אפשרויות הטיפול השונות.
הטיפול הראשוני כולל תרופות נוגדות דיכאון או/ונוגדות פירכוס, עם או ללא שילובם של תכשירים עוריים. שילובן של תרופות אופיואידיות נחשב לקו טיפול שני. מתן תרופות תוך ורידיות וביצוע חסימות עצב מהווה את עיקרי השלב הבא בטיפול. במקרים סלקטיביים יותר יבוצעו השתלות אלקטרודות, התערבות כירורגית או מתן אופיואידים תוך שדרתי. אין לשכוח לשלב טיפולים פיסיקליים ופסיכולוגיים, שהינם בעלי חשיבות עליונה להמשך תפקוד החולה.
מסלולי הולכת כאב לתרופות לדיכאון
מנגנון ליריקה פרהגבלין
דולוקסטין סימבלטה
ד"ר איתי גור-אריה, מנהל היחידה לשיכוך כאב, המערך להרדמה וטיפול נמרץ, המרכז הרפואי ע"ש חיים שיבא, תל השומר
ד"ר סילביו בריל, מנהל היחידה לטיפול בכאב, המרכז הרפואי ע"ש סוראסקי, תל אביב