לימפומה ראשונית של מערכת העצבים המרכזית (PCNSL) הינו גידול ממאיר נדיר יחסית ובעל משמעות קלינית רבה. זאת, עקב השכיחות העולה של גידול זה בשני עשורים האחרונים ועקב רגישותו הרבה לטיפולים אונקולוגיים. למרות שמבחינה פתולוגית הגידול דומה מאוד ללימפומות הסיסטמיות, הוא מפגין התנהגות ביולוגית שונה ודורש שימוש בדרכי אבחון וטיפול ייחודיות.
אפידמיולוגיה
במהלך 20 השנים האחרונות ההיארעות של PCNSL עלתה מ-1% לפני שנות ה-80 ל-3% עד 8% בשנות ה-90 וה-2000. העלייה יכולה להיות מוסברת לפחות בחלקה על ידי האפידמיה העולמית של תסמונת הכשל החיסוני הנרכש, אך נצפתה גם בקרב החולים האמונוקומפיטנטיים.
בניגוד ללימפומה סיסטמית המראה מגוון גדול של סוגים היסטולוגיים שונים, ברוב המכריע של PCNSL מדובר בגידול דיפוזי המורכב מתאי B גדולים
(diffuse large B-cell lymphoma), עם אחוזים בודדים בלבד של גידולים המורכבים מתאי T. התמונה ההיסטולוגית האופיינית היא של גידול ווזוצנטרי עם מעורבות של החללים הפריווסקולריים. אם ההיסטולוגיה היא אחרת מגידול מתאי B גדולים, מומלץ בירור נוסף לגילוי של לימפומה סיסטמית.
אבחון הגידול
האבחון של PCNSL צריך להיעשות מוקדם ככל האפשר במהלך הקליני של המחלה. הפרזנטציה הקלינית יכולה להיות שונה מאוד, בהתאם לדגם המעורבות של רקמת המוח על ידי המחלה. במקרים של מחלה רב-מוקדית, לעתים ניתן לראות התפתחות של תסמונת מוחית אורגנית עם נסיגה קוגניטיבית, ירידה במצב ההכרה, הפרעות הליכה וחוסר שליטה על תפקוד הסוגרים. במקרים אחרים בולטים בעיקר חסרים נוירולוגיים מוקדיים שונים בהתאם למיקום הגידול. כיוון שברוב המקרים של PSNCL המעורבות היא בעיקר של החומר הלבן העמוק של המוח, בניגוד לגידולי מוח אחרים, רק
כ-10% מהחולים מתחילים את מחלתם בהתקפים אפילפטיים.
ברוב המקרים האבחנה מבוססת על בדיקות הדימות של המוח. הבדיקה האופטימאלית היא תהודה מגנטית (MRI), אך לעתים טמוגרפיה ממוחשבת
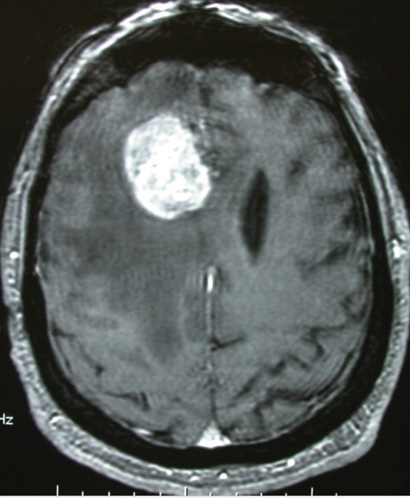
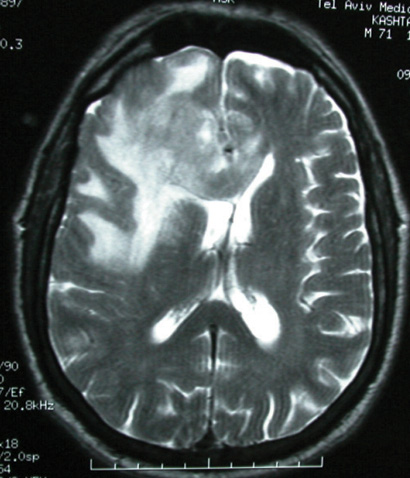
(CT) של המוח עם חומר ניגוד מספיקה על מנת לעורר חשד לקיומה של PCNSL. לרוב, בבדיקות CT הגידול נראה היפרדנסי, ב-MRI בסדרת 1T הוא היפראינטנסי (תמונה 1) ובסדרות 2T או FLAIR היפואינטנסי
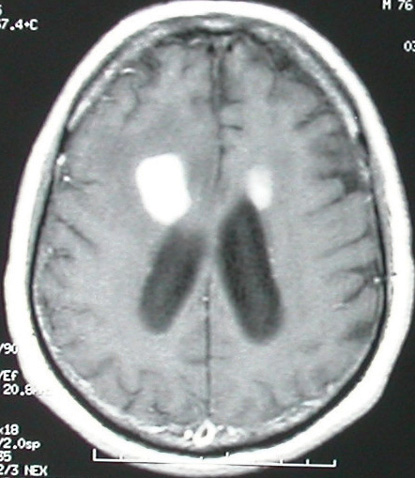
(תמונה 2). ברוב המכריע של המקרים, ישנה האדרה אינטנסיבית והומוגנית לאחר הזרקת חומר ניגוד, הן בבדיקת CT והן בסדרת 1T ב-MRI. האדרה "טבעתית" כה אופיינית לגידולי מוח גליאליים, אינה טיפוסית ל-PCNSL, אולם נצפית לעתים אצל חולים עם לימפומה מוחית על רקע AIDS. ביותר מ-30% מהמקרים, בדיקות הדימות מראות מחלה מוחית רב-מוקדית, עם מעורבות של החומר הלבן סביב מערכת חדרי המוח (תמונה 3). תמונה אופיינית אחרת הנצפית ביותר מ-50% של PCNSL היא של גידול מוחי האדרתי יחיד לעתים מוקף בצקת ווזוגנית הגורם לאפקט מאסה משמעותי (תמונה 1).
תמונה 1
תמונה 2
תמונה 3
חשוב מאוד שאפשרות של PCNSL תעלה באבחנה מבדלת כבר אחרי בדיקות הדימות הראשונות - דבר שעשוי למנוע התערבויות כירורגיות מיותרות, גם כאשר מדובר במקרים של גידול מוחי בודד וניתן לכאורה לכריתה מלאה. בכל מקרה של חשד ל-PCNSL ישנו צורך בביצוע ביופסיה מוחית בהקדם האפשרי. חשוב להקפיד לא להתחיל טיפול בסטרואידים עד לביצוע ביופסיה (כמובן, בתנאי שאי מתן סטרואידים לא מהווה סכנה מיידית לחיי החולה), כיוון שנטילת סטרואידים עלולה לגרום להרס מיידי של תאי הלימפומה, היעלמות האדרה בבדיקות הדימות ולשבש את מתן התשובה ההיסטולוגית. מתן סטרואידים ניתן בדרך כלל להתחיל מייד לאחר ביצוע ביופסיה.
כל חולה עם אבחנה של PCNSL צריך לעבור בדיקות נוספות להערכת דרגת המפושטות של המחלה. במקרים בהם אין הוראת נגד לביצוע ניקור מותני (בדרך כלל קשורות לאפקט מאסה ניכר וסכנת ההרניאציה), מומלץ לשלוח את נוזל השדרה לבדיקה ציטולוגית ו-flow cytometry, כמו גם לבדיקות מעבדה שגרתיות (רמות חלבון וסוכר). בדיקה של immunoglobuline gene rearrangement עשויה להגביר את רגישות הבדיקה הציטולוגית ולעזור באבחון של פיזור לפטומנינגיאלי של המחלה גם במקרים בהם כמות תאי הלימפומה בנוזל השדרה היא קטנה מאוד. ישנם מומחים הממליצים לבצע ניקור מותני בכל המקרים עם חשד ל-PCNSL לפני הביופסיה המוחית, למרות שהיעילות של בדיקה זו לצורך אבחנה של PCNSL הינה נמוכה ובדרך כלל אינה מונעת ביצוע ביופסיה מוחית.
כ-10% עד 25% מהחולים עם PCNSL, מפתחים מעורבות עינית כבר בתחילת המחלה, לכן כל חולה עם PCNSL צריך לעבור בדיקת עיניים במנורת סדק.
בכל מקרה של המחלה יש לבצע בירור מעבדתי מקיף, הכולל בדיקות דם ל-HIV ובדיקות של מצב המערכת החיסונית. בספרות ישנם חלוקי דעות לגבי הצורך לבצע בדיקת CT כל גופי או בדיקת PET עקב סיכון נמוך מאוד
(כ-1%) של PCNSL לפיזור גרורתי מחוץ למערכת העצבים והעיניים. עם זאת, מדובר בבדיקה לא פולשנית שעשויה לסייע להערכת מצב גופני ולשלילת נוזלים ב-third space (בחללי הפלאורה, הפריקרד או בחלל הצפקי) לפני תחילת טיפול על ידי מתוטרקסט במינון גבוה. ביצוע ביופסיית מוח עצם בדרך כלל אינה מומלצת במקרים של PCNSL.
פרוגנוזיס וטיפול
התחזית במקרים של PCNSL ללא מתן טיפול אונקולוגי היא קשה מאוד, עם תוחלת חיים של פחות מ-4 חודשים. חולים בודדים יכולים להגיב תקופות ארוכות למדי לטיפול בסטרואידים בלבד. גיל מתקדם (יותר מ-60), מצב תפקודי ירוד ופיזור המחלה מעבר למוח הגדול (נוזל השדרה, עיניים), מהווים גורמים פרוגנוסטיים שליליים. עם זאת, בניגוד לגידולי מוח גליאליים, מצב תפקודי נמוך של החולה אינו מצדיק מעבר לטיפול פליאטיבי, כיוון שמתן מיידי של טיפול אונקולוגי מתאים, עשוי לגרום לשיפור מהיר במצבו הקליני של החולה.
לפני שנות ה-80, הטיפול הסטנדרטי המקובל ל-PCNSL היה טיפול קרינתי לכל המוח (whole brain radiation therapy, WBRT). טיפול זה גורם ברוב המכריע של החולים להיעלמות מהירה או הקטנה משמעותית של המחלה ולשיפור קליני בהתאם. עם זאת, אחרי WBRT המחלה חוזרת בדרך כלל תוך שנה ממתן הטיפול. בעיה נוספת הקשורה ל-WBRT היא התפתחות תגובה נוירוטוקסית, לעתים קשה מאוד וגורמת לנכות נוירולוגית בלתי מתקבלת על הדעת, במיוחד בקרב אנשים מעל גיל 65. ניסיונות רבים להשתמש בפרוטוקולים של טיפולים כימיים המקובלים במקרים של לימפומה סיסטמית כשלו, ככל הנראה עקב אי יכולת של התרופות (בראש וראשונה אדריאמיצין) לחדור דרך מחסום דם-מוח ולהיכנס בצורה יעילה לרקמת המוח המסוננת על ידי הגידול.
שינוי משמעותי בתוצאות הטיפול והפרוגנוזה של PCNSL הסתמן לפני כ-20 שנה עם תחילת השימוש במתוטרקסט במינון גבוה (high-dose Methotrexate, HDM). רוב הפרוטוקולים המקובלים היום מבוססים על HDM, בדרך כלל בשילוב עם תרופות ציטוטוקסיות אחרות, כולל תרופות ממשפחות האלקילטורים והאנטימטבוליטים, לעתים בשילוב עם נוגדנים מונוקלונליים (rituximab - נוגדן מונוקלונלי לתאי B בעלי סמן CD20) - בלי או עם מתן WBRT. תוצאות המחקרים הקליניים של 10 השנים האחרונות תומכות בגישה טיפולית זו עם השגת תוחלת החיים החציונית הגבוהה מ-3 שנים.
הצורך בהזרקות של תרופות כימיות לתוך נוזל השדרה (מרכיב סטנדרטי של טיפול ב-PCNSL לפני כ-20 שנה) מוטל בספק בשנים האחרונות, במיוחד בחולים עם בדיקות ציטולוגיות שליליות של נוזל השדרה. השימוש במינונים גבוהים של מתוטרקסט (8 גרם למטר מרובע), משיג רמות ציטוטוקסיות של התרופה בנוזל השדרה וגורם ליעילות זהה של טיפול עם ירידה בשיעור של תופעות הלוואי. רוב הפרוטוקולים הפעילים של PCNSL בנויים בצורת "סנדוויץ'": טיפול כימי מבוסס על HDMTX (induction), מתן WBRT לאחר השגת תגובה לטיפול כימי ראשוני ולאחר מכן שוב טיפול כימי
(consolidation). בעשור האחרון נעשו ניסיונות של הימנעות ממתן קרינתי למוח, תוך שימוש בשיטות שונות של dose intensification של כמותרפיה, כולל פתיחה אוסמוטית של מחסום דם-מוח והשתלה עצמית של תאי אב משולבת עם מתן טיפול כימי במינון גבוה. בחולים מעל גיל 65 בהם שתי השיטות הללו אינן ניתנות ליישום והסיכון להשפעה טוקסית קשה של טיפול קרינתי הוא גבוה במיוחד, נבדקת אפשרות של מתן קרינה במינון מופחת (24 Gy) משולבת עם מתן Temozolomide דרך הפה. תרופה זו השייכת למשפחת האלקילטורים ונמצאת בטיפול בגידולי מוח גליאליים הודות ליכולתה לחדור דרך המחסום דם-מוח, עשויה ככל הנראה לשמש תחליף ל-HD MTX בחולים אשר אינם יכולים לקבל מתוטרקסט עקב תופעות לוואי או סיבות אחרות.
בשנים האחרונות נבדק תפקיד rituximab בטיפול משולב של PCNSL. תרופה זו נכללה לפני שנים בטיפול סטנדרטי בלימפומה סיסטמית, אך לא נבדקה ב-PCNSL, כיוון שבתור מולקולה גדולה מאוד אינה מסוגלת לחדור דרך מחסום דם-מוח. בשנים האחרונות ישנה נטייה לכלול את rituximab בפרוטוקולים הטיפוליים של PCNSL, במיוחד בשלב של induction, כאשר הגידול עדיין קולט חזק את חומר הניגוד בבדיקות הדימות - דבר המשקף פגיעה ניכרת במחסום דם-מוח. היו גם דיווחים של מתן rituximab בזריקות לתוך נוזל השדרה אצל חולים עם פיזור לפטומנינגיאלי של PCNSL.
מעורבות העין ב-PCNSL מהווה בעיה טיפולית לא פשוטה. הטיפול הסטנדרטי של המחלה העינית בעבר היה טיפול קרינתי לאזור העיניים. אולם, גם אם יעיל לחיסול תאי הלימפומה, טיפול זה עלול לגרום לתופעות לוואי לא קלות, כולל קטרקט, יובש קשה בעיניים, פגיעה ברשתית ואטרופיה של העצב האופטי. שימוש ב-HD MTX עשוי לגרום לתגובה של המחלה בעיניים, אך עם הישנות עינית ביותר מ- 50% של המקרים. בעשור האחרון גבר השימוש בהזרקות של MTX לתוך הנוזל הזגוגי של העין כאלטרנטיבה לטיפול קרינתי המאפשרת להשיג תוצאות טובות לטווח ארוך עם סיכון נמוך לתופעות לוואי עיניות. הטיפול ניתן במשך מספר חודשים על ידי רופא עיניים מנוסה בטכניקה זו.
טיפול בהישנות (salvage treatment)
התחזית במקרים של מחלה חוזרת היא הרבה יותר קשה מזו של PCNSL בעת האבחון. הגישה הטיפולית תלויה בסוג הטיפול שהחולה קיבל בעבר ובפרק הזמן בין סיום הטיפול ובין הישנות המחלה. במקרים של הישנות מאוחרת (חודשים ושנים לאחר סיום הטיפול) ניתן להשתמש שוב ב-HD MTX, לעתים בשילוב עם תרופות ציטוטוקסיות אחרות ו-rituximab (הישנות מוקדמת מצביעה על כשלון הטיפול והתפתחות של עמידות ל-MTX). מתן טיפול קרינתי מהווה אופציה טיפולית טובה לחולים שלא קיבלו קרינה כחלק מהטיפול הראשוני. תרופות ציטוטוקסיות שונות בעלות יכולת לחדור דרך המחסום דם-מוח נבדקות במקרים של PCNSL חוזרת. Topotecan הראה יעילות במספר מחקרים קליניים, אך טיפול בו יכול לגרום לפגיעה ניכרת במוח העצם - דבר אשר עלול להגביל את שימושו. במקרים מובחרים ניתן לשקול טיפול על ידי בפתחה אוסמוטית של מחסום דם-מוח, תוך שימוש בפרוטוקולים אשר אינם כוללים MTX (למשל, פרוטוקולים המבוססים על מתן Carboplatin) או השתלה עצמית של תאי אב המטופואטיים עם טיפול כימי במינון גבוה. אולם, אטרקטיביים ככל שיהיו מבחינה תיאורטית, טיפולים אלה לא הוכחו כיעילים במחקרים קליניים מבוקרים.
תופעות לוואי הקשורות לטיפול
כבר לפני כ-20 שנה התברר ששיעור גבוה של חולי PCNSL אשר שרדו יותר מ-6 חודשים פיתחו תסמונת נוירולוגית קשה הכוללת שיטיון פרוגרסיבי, הפרעות הליכה והפרעות שליטה על מתן השתן. בדיקות הדימות של המוח הראו במקרים הללו אטרופיה מוחית ניכרת ושינויים מפושטים בחומר הלבן. אלו הסימנים הקליניים והרדיולוגיים של אנצפלופתיה הנגרמת על ידי מתן טיפול קרינתי למוח. הסיכון של התפתחות האנצפלופתיה בצורה קשה עולה עם גיל החולה. מתן HD MTX ומתן וטיפול ציטוטוקסי לתוך נוזל השדרה מהווים גם כן גורמים בלתי תלויים להתפתחות של אנצפלופתיה. התזמון של טיפול קרינתי וטיפול כימי משחק תפקיד חשוב בהתפתחות של פגיעה מוחית - מתן HD MTX אחרי WBRT גורם לתגובה טוקסית ניכרת יותר מאשר אותו טיפול הניתן לפני הטיפול הקרינתי. התפתחות של שיטיון קשה, במיוחד בקשישים, הינה גורם עיקרי לניסיונות חוזרים לבנות פרוטוקול טיפולי יעיל המאפשר הימנעות מטיפול קרינתי או מתן קרינה במינון מופחת.
תופעת לוואי עיקרית של HD MTX קשורה לפגיעה כלייתית אפשרית. ניתן להפחית את הסיכוי לפגיעה כלייתית קשה על ידי הקפדה של הפרוטוקול הטיפולי, כולל הערכה של התפקוד הכלייתי לפני מתן טיפול, מתן נוזלים בכמות הנדרשת ומתן leucovorin במינון המתאים תוך ניטור אחרי רמות של MTX בדם. תופעות לוואי אחרות (פגיעה בריאות, פגיעה בכבד, ירידה קשה בספירות הדם, מוקוזיטיס ועוד) הן נדירות יחסית.
כיוונים לעתיד
PCNSL, בניגוד לגליומות ממאירות, מהווה דוגמה לגידולי מוח הניתנים לטיפול, ובמקרים מובחרים אף לריפוי. אין ספק שהסיבה לכך היא רגישות רבה של גידול זה לטיפול כימי וטיפול קרינתי. המשימה העיקרית היום היא למצוא את הפרוטוקול הטיפולי האופטימאלי בעל יעילות מרבית עם תוחלת חיים ארוכה וללא תופעות לוואי קשות ובלתי הפיכות. דבר זה דורש ביצוע מחקרים קליניים בעלי פאזה II ו-III. בהתחשב להיארעות הנמוכה של PCNSL, דרוש מאמץ רב מרכזי ובינלאומי על מנת לגייס כמות מספקת של מטופלים תוך זמן סביר. מספר מחקרים קליניים אשר מתנהלים עתה ברחבי העולם עשויים לתת תשובות לחלק מהשאלות החשובות הקשורות לקביעת טיפול אופטימאלי למחלה זו.
ד"ר דבורה בלומנטל וד"ר פליקס בוקשטיין, שירות נוירו-אונקולוגי, מרכז רפואי תל אביב
רשימת מקורות
Gerstner E, Batchelor T. Primary CNS lymphoma. Expert Rev Anticancer Ther. 2007;7:689-700. DeAngelis LM, Seiferheld W, Schold SC, Fisher B, Schultz CJ; Radiation Therapy Oncology Group Study 93-10. Combination chemotherapy and radiotherapy for primary central nervous system lymphoma: Radiation Therapy Oncology Group Study 93-10. J Clin Oncol. 2002;20:4643-8. Batchelor T, Carson K, O'Neill A, et al. Treatment of primary CNS lymphoma with methotrexate and deferred radiotherapy: a report of NABTT 96-07. J Clin Oncol. 2003;21:1044-9. Wong ET. Salvage therapy for primary CNS lymphoma with a combination of rituximab and temozolomide. Neurology. 2004;63:901-3. Doolittle ND, Jahnke K, Belanger R, et al. Potential of chemo-immunotherapy in relapsed primary central nervous system (CNS) lymphoma. Leuk Lymphoma. 2007;48: 1712-20. |