נ', אישה צעירה, בת 38, מורה למתמטיקה במקצועה, נכנסת למשרדי כעלה נידף. יושבת. הדמעות זולגות בשקט. האבחנה: סרטן נזופרינקס שהתגלה בשלב מתקדם, למרות ביקורים תכופים והולכים אצל רופא המשפחה. אני מולה, בודקת, ממששת, מסתכלת בדפים עם האבחנה החד משמעית, עם תוצאות ההדמיה המפחידות. זה הזמן לספר לה על הצפוי, על הטיפול המשולב של קרינה עם כימותרפיה הממתין לה, על השנה שתהיה קשה. הכל הסתיים. נ' היא כעת בת 46, שמונה שנים מהאבחנה. בריאה בתכלית. ללא עדות למחלה פעילה, אבל עם קסרוסטומיה (ירידה בהפרשת רוק ויובש בפה) ופגיעה בשיניים ובטעם, פגיעה בתפקודי בלוטת התריס, צרידות.
למרות שרק שמונה שנים חלפו מאז, טכניקת הקרינה השתפרה באופן משמעותי, עם הפחתה בשיעורי תופעות הלוואי לטווח הקצר והארוך. לתכנון הקרינה משתמשים ב-CT וב-PET-CT באבחנה, הסימולציה מתבצעת על ידי CT כדי שנוכל לסמן את אזור המטרה ואת האיברים הסמוכים, הבריאים. ניתן לבצע שילוב תמונת ה-MRI עם תמונת ה-CT בזמן הסימולציה כדי לראות טוב יותר גידולי מוח, ותכנון הקרינה והמתן נעשה בתוכנות חדשות שמחשבות את המנה לכל נקודה ומאפשרות הסתכלות תלת ממדית על אזור הטיפול. בגידולי הראש והצוואר למשל, הקרינה ניתנת בטכניקת IMRT, טכניקת קרינה מדויקת ה"חוסכת" קרינה לאיברים בריאים.
עד כאן טכניקה. מכאן עולה גם השאלה האם יש דרך נוספת, פרמקולוגית, להגן על הרקמה הבריאה, שיושבת בסמיכות לרקמת הגידול, מפני הקרינה?
בסקירה זו נספר על אפשרויות ההגנה על תאים בריאים תוך כדי קרינה על ידי שימוש בתרופות מגינות (Radioprotectors).
כדי להבין את הרציונל לטיפול בחומרים מגינים מפני קרינה יש לדון בשתי הבנות בסיסיות. הראשונה היא השימוש במושג "היחס הריפויי",
Therapeutic ratio) TR) המוגדר כיכולת שליטה בגידול/ פגיעה ברקמה הבריאה. כפי שניתן לראות באיור מספר 1, שני הפרמטרים הם תלויי מנה, וההבדל האופקי ביניהם, הנקבע לכל טיפול, ינבא האם ניתן להשתמש בצורת טיפול זו בצורה בטוחה. ככל שההפרש בין העקומות גדול יותר, כך עולה הסיכוי לטיפול אפקטיבי ללא תופעות לוואי קשות.
איור מס' 1
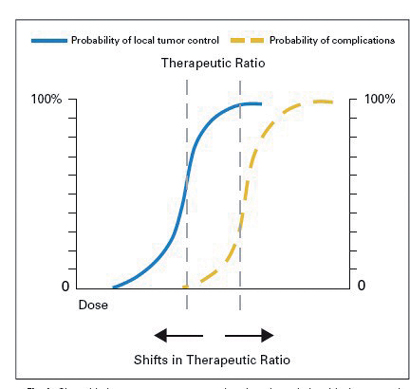
התובנה השנייה היא כי היחס בין האפקטיביות לרעילות של תכשיר אפשרי שהוא רדיופרוטקטור משפיע ישירות גם על היחס הריפויי (TR).
רדיופרוטקטור, שבנוסף לפעילותו המגינה, מוריד מיעילות הקרינה (עקומת השליטה בגידול וגם עקומת הרעילות זזות ימינה), וייתכן שלא ישנה כלל את ה-TR או אפילו יוריד אותו. כמובן, לרעילותו של התכשיר חשיבות רבה, ואם קיים אחוז גבוה של תופעות לוואי ייתכן שהתכשיר אינו ראוי לשימוש למרות יעילותו נגד נזקי קרינה.
קיימים שלושה סוגי תרופות:
א. תרופות מגינות - ניתנות לפני הקרינה במטרה למנוע את הנזק. אבטיפוס בקבוצה זו הוא אמיפוסטין (Amifostin).
ב. תרופות הניתנות להקלה (Mitigation), אחרי הקרינה, אך בטרם ניתן להבחין בנזק ומטרתן להפחיתו. דוגמה לתרופה בקבוצה זו היא Palifermin.
ג. תרופות הניתנות כטיפול אחרי שהנזק כבר נגרם, כמו רוק מלאכותי וסוכרלפט.
אחרי שהנזק כבר נגרם, כמו רוק מלאכותי וסוכרלפט.
- ניתנות לפני הקרינה במטרה למנוע את הנזק. אבטיפוס בקבוצה זו הוא אמיפוסטין (Amifostin).אחרי הקרינה, אך בטרם ניתן להבחין בנזק ומטרתן להפחיתו. דוגמה לתרופה בקבוצה זו היא Palifermin. אחרי שהנזק כבר נגרם, כמו רוק מלאכותי וסוכרלפט.
בסקירה זו נדון בשתי הקבוצות הראשונות.
אמיפוסטין
הקרינה גורמת לנזק בדנ"א על ידי פגיעה ישירה בגנום, או על ידי פגיעה לא ישירה בדנ"א תוך כדי יצירה של רדיקלים חופשיים הגורמים להרג התא, מוטגנזיס, טרנספורמציה וקרצינוגנזיס (איור מספר 2).
איור מס' 2
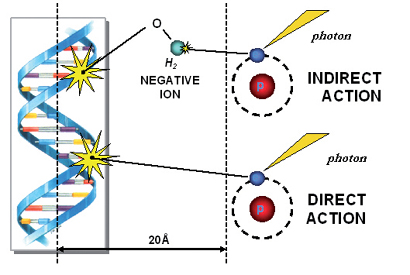
הלכה למעשה, מנגנון הפגיעה על ידי הרדיקלים החופשיים אחראי ל-75 אחוז מהנזק הנגרם מקרינה. מנגנונים האוספים ומנטרלים במהירות את הרדיקלים החופשיים, ונמצאים במיקרו-סביבה של התאים הנפגעים, מורידים את הפגיעה התאית. הפגיעה הישירה מתרחשת במהירות כה גדולה, עד כי אין מנגנון פרמקולוגי שיכול למנוע אותה.
במקור, אמיפוסטין פותחה על ידי סוכנות צבאית אמריקאית שסקרה אוסף תרכובות של אמינוטיאולים מתוך מטרה למצוא חומרים מגנים מפני נשורת גרעינית. על פני התא נמצא אלקלין פוספטז ההופך את האמיפוסטין (שהוא Prodrug) למטבוליט הפעיל, WR-1065, שהוא תיול חופשי (Free thiol). במיוחד מתרכז האמיפוסטין בבלוטות רוק ובכליה. תיול זה אוסף אליו רדיקלים ומגביר את תיקון הדנ"א לאחר חשיפה לקרינה מייננת. על דופן תאי גידול קיימים פחות אלקלין-פוספטזות מאשר ברקמות הבריאות ולכן באופן תיאורטי, אמיפוסטין מגן על התאים הבריאים, הסובבים את תאי הגידול, מפני הקרינה. הצפי הוא שבמחלות שבהן הפרוגנוזה גרועה למרות טיפול, ניתן יהיה להעלות את מינון הקרינה כדי לשפר את השליטה במחלה, ובסרטן עם פרוגנוזה טובה, ניתן יהיה להוריד את הרעילות של הטיפול במנה האפקטיבית.
מחקר בפאזה שלישית, שהתנהל בשנים 1996-1995 בחולים עם סרטן הראש והצוואר, שם לו למטרה לבדוק האם אמיפוסטין מוריד היארעות של קסרוסטומיה אקוטית וכרונית ומוקוזיטיס מקרינה (Brizel, JCO, 2000). החולים חולקו לשתי קבוצות אקראיות, וקבוצת האמיפוסטין קיבלה מדי יום, לפני הקרינה, עירוי של התרופה. במעקב של שנתיים אחרי 300 המטופלים במחקר נמצא שאכן הייתה ירידה בקסרוסטומיה האקוטית והכרונית, אך לא היה הבדל במוקוזיטיס. השיפור בקסרוסטומיה הפך להיות בלתי משמעותי אחרי שנתיים, תופעה המעידה על תיקון מאוחר של נזקי הקרינה לבלוטות הרוק.
תופעות הלוואי הקשות של האמיפוסטין נצפו בפחות מעשרה אחוזים מהמטופלים, בעיקר בחילה, הקאה וירידה זמנית בלחץ הדם. לשני שלישים מהחולים היו תופעות דומות בעוצמה פחותה, וכ-20 אחוז הפסיקו את הטיפול בשל רעילותו לפני סיום הקרינה. אפילו שינוי של אופן המתן, מעירוי תוך ורידי למתן תת עורי שהביא לירידה בבחילה, בהקאה ובירידה של לחץ הדם, לא שיפר את אחוז המטופלים שסיימו את הטיפול בתרופה בגלל תופעות עוריות בחומרה משתנה, עד כדי אריתמה מולטיפורמה, סטיבנס-ג'ונסון ואפידרמל נקרוליזיס.
מחקרים נוספים שבהם נבדקה יכולתה של התרופה להגן על איברים חיוניים במהלך קרינה כטיפול בודד או בשילוב עם כימותרפיה, כמו בסרטן הריאה ובסרטן צוואר הרחם, הדגימו שיפור קל בתופעות הלוואי של הקרינה עם האמיפוסטין, אך רעילותה של התרופה הובילה להפסקת המתן והקשתה על השימוש בה לאורך כל זמן הטיפול.
ה-FDA אישר את השימוש באמיפוסטין כטיפול להורדת היארעות קסרוסטומיה בקרינה כטיפול בודד (ללא שילוב של כימותרפיה), וכיוון שמתן קרינה כטיפול מרפא כולל לעתים קרובות כימותרפיה (כמו בסרטן הראש והצוואר, צוואר הרחם, הריאה, הוושט ועוד), הרי שזוהי אינה תרופה מאושרת בארה"ב במשלב קרינה-כימותרפיה. כיום, אמיפוסטין לא נמצא בשימוש קליני רוטיני ברוב העולם (בעיקר בשל רעילותו), אך מתבצעים מחקרים להערכת יכולת ההגנה של החומר בשיטות מתן שונות ולא במתן לווריד. לדוגמה, במתן אנדורקטלי יומי במהלך קרינה לערמונית.
פליפרמין
פליפרמין (Palifermin) הוא אבטיפוס בקבוצה זו והוא פקטור גדילה הומני, רקומביננטי, של קרטינוציטים, ושייך לציטוקינים ממשפחת פקטורי הגדילה של הפיברובלסטים FGF-7 (Fibroblast growth factor family of cytokines).
הפליפרמין מעודד פרוליפרציה תאית והתמיינות במגוון תאים אפיתליאליים, כמו בתאי מוקוזה במערכת העיכול, בבלוטות הרוק ובפנאומוציטים מסוג II. כמו כן, הוא אחראי על רגולציה של מנגנוני הגנה תאיים דרך גלוטטיון. במחקרים פרה-קליניים במכרסמים נצפתה התעבות המוקוזה של הלשון לאחר מתן פליפרמין. במחקרים עוקבים נראה כי תוספת פליפרמין לאחר קרינה הובילה לעלייה במינון הקרינה הנדרשת כדי לגרום למוקוזיטיס מכויבת, ולקיצור זמן ההחלמה של המוקוזיטיס לאחר שזו כבר נגרמה. בבלוטת הפרוטיס נשמרה יכולת ייצור הרוק ואף נראה כי קיימת ירידה בחומרת פנאומוניטיס ופיברוזיס ריאתי הנגרמים מפרקציה גדולה ובודדת של קרינה, במודלים של מכרסמים.
ספילברג פרסם ב-New England Journal of Medicine בשנת 2004 את המחקר שהיווה את אבן הפינה הקלינית של התרופה, מחקר בפאזה III, כפול סמיות, בחולים עם לימפומה שאינה הודג'קין שעברו השתלת מח עצם. המנה האבלטיבית לכל הגוף total body irradiation) TBI) הייתה 12 Gy ולאחר מכן ניתנה כימותרפיה. פליפרמין ניתן לפני הטיפול הקרינתי ואחרי הטיפול הכימותרפי. 212 חולים חולקו לשתי קבוצות, אחת קיבלה פלצבו והשנייה פליפרמין. מוקוזיטיס בדרגה 4-3 (מוקוזיטיס קשה - קשה ביותר) התפתחה אצל 90 אחוז בקבוצת הפלצבו ורק אצל 60 אחוז בקבוצת הפליפרמין. גם משך המוקוזיטיס התקצר מ-10.4 ימים ל-3.7 ימים (p<0.001). מוקוזיטיס בדרגה 4 התפתחה אצל 62 אחוז בקבוצת הפלצבו אך רק אצל 20 אחוז בקבוצה המטופלת (p<0.001) וכן נצפתה ירידה של 50 אחוז בתקופת המוקוזיטיס, מ-6.2 ל-3.3 ימים (p<0.001).
למרבה האכזבה, כאשר נוסה פליפרמין בגידולי הראש והצוואר בשילוב של קרינה עם כימותרפיה במחקרי פאזה I-II, לא נצפתה ירידה בשיעורי המוקוזיטיס ובמשכו, למעט בתת קבוצה שקיבלה קרינה פעמיים ביום, שם חל שיפור משמעותי במדדים אלו. יש מספר הסברים אפשריים לחוסר הפעילות של הפליפרמין בקבוצה טיפולית זו לעומת קבוצת הלימפומה שהוזכרה לעיל, ביניהם הבדלים גדולים במינון הקרינה שניתנה, מנת פליפרמין נמוכה מהנדרש, כמות המוקוזה שהוקרנה, ומשך הזמן שלאורכו בוצע מעקב אחרי המטופלים. כיום מתבצעים מחקרים הבודקים את יעילות התרופה בגידולי הראש והצוואר במטופלים המקבלים קרינה וכימותרפיה, הפעם במינונים גבוהים יותר של פליפרמין.
לאחרונה פורסמו מספר מחקרים העוסקים ב-Gene therapy, בהם מוחדר Manganese superoxide dismutase plasmid liposome לגוף בבליעה או על ידי נבולייזר, ומגן על התאים הבריאים מקרינה. מתן לווריד הגן על עכברים מקרינה כל-גופית והוריד את שיעורי התמותה.
מובן שבשנים האחרונות, עקב העלייה באיום של נשק רדיואקטיבי שיגיע לידיים הלא נכונות וגם יבוא לידי שימוש, יתפתח מחקר ענף שיבדוק דרכים להגן על התאים הבריאים ועל הגוף כולו מקרינה. מי שיטופל בקרינה יזכה גם הוא מפיתוח תרופות כאלו להורדה של תופעות הלוואי במהלך ואחרי קרינה.
לסיכום, כיום אין בידינו אמצעים פרמקולוגיים יעילים להגן על הרקמה הבריאה מפני הקרינה. כיוון שלקרינה תפקיד משמעותי בריפוי גידולים ממאירים ושיעורי הריפוי עולים עם שילוב כימותרפיה וטיפולים מונחי מטרה, הרי שלמטופלים צפויה תוחלת חיים ארוכה ויש חשיבות רבה במניעת תופעות הלוואי לטווח ארוך.
ד"ר מירב בן-דוד, יחידת הקרינה במערך האונקולוגי, בית החולים ע"ש שיבא, תל השומר