מחלת גושה היא מחלת האגירה הליזוזומלית השכיחה ביותר מקרב מחלות האגירה. המחלה עוברת בתורשה אוטוזומלית רציסיבית וקיימת העדפה אתנית ליהודים ממוצא אשכנזי, כאשר ההערכה היא שאחד מ-17 יהודים אשכנזים הוא נשא של המחלה. לפי הערכה זו, אחת מ-850 לידות חי היא של חולה גושה, אך בפועל מוכרים בארץ רק כ-700 חולים, דבר המצביע על ריבוי מקרים אסימפטומטיים שאינם מגיעים לתשומת לב המערכת הרפואית. עם זאת, המחלה קיימת בכל קבוצות האוכלוסיה ברחבי העולם וכיום מוכרים כ-6,000 חולים בכל העולם מתוך כ-40-30 אלף שכנראה קיימים לפי שכיחות הגן באוכלוסיה הכללית.
הגן האחראי למחלה מופה לכרומוזום מס' 1 וכיום ידועות למעלה מ-200 מוטציות שונות בגן המקדד את האנזים הליזוזומלי β - גלוקוצרברוזידאז. פגיעה ברמת הייצור או התפקוד שלו מביאה לאגירה של הסובסטרט של האנזים, גלוקוצרברוזיד, בליזוזומים של תאים מונוציטים-מאקרופאג'ים, שבהמשך הופכים להיות "תאי גושה" הנאגרים בעיקר בטחול, בכבד ובמח העצם.
אבחון המחלה מבוסס על מדידת פעילות האנזים בתאי דם פריפריים, כשלעצמה אינה מלמדת על חומרת המחלה, יחד עם בדיקת DNA למוטציות השכיחות באוכלוסיה הנבדקת, באמצעותן ניתן לחזות רק באופן כללי ביותר מה יהיה סוג המחלה וחומרתה.
קלסיפיקציה ומאפיינים קליניים
מחלת גושה מחולקת באופן קלאסי לשלושה סוגים בהתאם לקיום וחומרת המעורבות הנוירולוגית.
Type 1 - זהו הסוג השכיח ביותר המוגדר על ידי העדר מעורבות מערכת העצבים המרכזית. במרבית המקרים קיימת המוטציה "המגינה"
1226G) N370S) על אלל אחד לפחות. המוטציה הזו שכיחה בעיקר בקרב האוכלוסיה האשכנזית אך קיימת גם בקרב אוכלוסיות אחרות אך בשכיחות נמוכה בהרבה. ביטויי המחלה מגוונים ביותר, החל בחולים שהם אסימפטומטיים לחלוטין המתגלים בשל בדיקות סקר וכלה בחולים הסובלים ממעורבות קשה של מערכת השלד.
מרבית החולים סובלים במידה זו או אחרת מסימפטומים הקשורים בהגדלת טחול וכבד המתבטאים בהגדלת הבטן, אנמיה ותרומבוציטופניה בדרגות שונות, מעורבות השלד החל בכאבים וכלה באוטמים בעצמות הארוכות. עיכוב בצמיחה לגובה בילדים נפוץ למדי, בעוד שהמעורבות הריאתית מופיעה באופן נדיר ובקרב החולים הקשים.
יש אינדקס חומרה, שבשעתו נוצר לצורך בדיקת הקשר בין המוטציות (הגנוטיפ) והמהלך הקליני (הפנוטיפ), אשר מנקד את חומרת המחלה לפי מעורבות הטחול והכבד (בבדיקה פיזיקלית), ממצאי מעבדה עיקריים (ספירת דם ותפקודי כבד), הגיל שבו התגלתה המחלה ומידת המעורבות הגרמית.
Type 2 - הסוג הנוירונופתי הקשה ביותר. סוג זה הוא נדיר מאוד וסימניו החמורים מופיעים כבר בחודשים הראשונים לחיים. המוטציה הנפוצה היא 1448C) L444P) יחד עם מוטציה קשה נוספת (מוטציה קשה מוגדרת על ידי מעורבותה בסוגים הנוירונופתיים). הפרוגנוזה גרועה ביותר והילדים נפטרים בגיל חודשים אחדים עד שנתיים, בדרך כלל מסיבוכים נשימתיים משניים להידרדרות נוירולוגית חמורה3. לפני כעשר שנים תואר וריאנט של סוג קטלני זה, הדומה למודל עכבר Knock out שבו היילוד סובל מהידרופס פטאליס ואיכטיוזיס ואינו יכול לשרוד מעבר לשעות אחדות עד יומיים.
Type 3 - זהו סוג ביניים נוירולוגי עם מעורבות ויסצרלית ונוירולוגית פחות חמורה מאשר בסוג הקודם. המעורבות הנוירולוגית בדרך כלל כוללת הפרעה בתנועות גלגלי העיניים במישור ההוריזונטלי (Supranuclear gaze palsy). הסימפטומים מתחילים להופיע בגיל הילדות המוקדמת ותוחלת החיים הצפויה ללא טיפול אנזימי היתה בדרך כלל עד שנות ה-20. גם כאן המוטציה (L444P (1448C נפוצה ביותר ובדרך כלל תופיע במצב הומוזיגוטי. יש חלוקת משנה לצורה זו, A3 עם מעורבות נוירולוגית בולטת ומעורבות ויסצראלית פחותה, B3 - הפוך (הפרעה בתנועת גלגלי העיניים כביטוי נוירולוגי עיקרי אך עם מחלה סיסטמית קשה, לרבות מעורבות ריאתית. בנוסף, תואר תת סוג נוסף (C3) עם מעט מעורבות ויסצראלית כמו
ב-A3 ומעט מעורבות נוירולוגית כמו ב-B3, אך עם הסתיידויות קשות ביותר של מסתמי הלב והעורקים הגדולים. בצורה האחרונה, כל החולים הומוזיגוטים למוטציה נדירה D409H.
יש לציין שבתקופה האחרונה, בעקבות דיווחים על שכיחות מעט מוגברת של מחלת פרקינסון בקרב חולי גושה עם 1 Type (ואגב, גם בנשאים) כמו גם שכיחות מוגברת של תסמינים נוירולוגיים שונים, יחד עם ממצאים היסטופתולוגיים מסוימים במוח בנתיחות לאחר המוות, יש המציעים להתנתק מהחלוקה לשלושה סוגים ולהתייחס למחלת גושה כאל מחלה בעלת רמות חומרה המשכיות ממצב אסימפטומטי לחלוטין ועד הצורה הקטלנית ביותר עם הידרופס פטאליס ואיכטיויזיס.
עם זאת, לחלוקה הקלאסית יישומים קליניים ופרוגנוסטיים חשובים: בעוד הסוג הראשון מגיב היטב לטיפול האנזימי, הרי שבצורות הנוירונופאתיות אין, לצערנו, השפעה ממשית לטיפול האנזימי על הפגיעות המוחיות, מן הסתם עקב אי יכולתו של האנזים כמולקולה גדולה לחצות את המחסום דם-מח.
אבחנה ראשונית ובדיקות המעקב
בדיקת פעילות האנזים גלוקוצרברוזידאז בכדוריות דם לבנות (בדיקת דם ורידי רגילה מבחינת החולה) מהווה בדיקת הבחירה וה-Gold standard לקביעת האבחנה. התשובה היא חד משמעית: יש גושה (בדרך כלל פעילות נמוכה מכ-20 אחוז מפעילות האנזים בדגימת ביקורת) או אין גושה, כאשר היכולת לזהות נשאים קיימת אך אינה מדויקת. זיהוי המוטציות (הגנוטיפ) חשוב הן לצורך ייעוץ גנטי (מאפשרת זיהוי מדויק של נשאים במשפחת החולה) והן לצורך ניבוי חומרת המחלה במידה מסוימת והצורך בקבלת טיפול בעתיד. לצערנו, למרות שהאבחון האנזימי קיים עוד מראשית שנות ה-70, עדיין חולים רבים מאובחנים על סמך זיהוי תאי גושה בשאיבת מח עצם, וכאשר זו נעשית מראש לצורך אבחון גושה (ולא בגין חשש למחלה המטולוגית אחרת), הרי הדבר פגום.
מתי לחשוד במחלת גושה
לעולם לא ניתן לשלול מחלת גושה שכן המחלה יכולה להיות אסימפטומטית לחלוטין ולהתגלות אך ורק בבדיקה ספציפית של פעילות האנזים או בזיהוי המוטציות. אולם, קיימת חשיבות לזהות מוקדם את המחלה בחולים שעיכוב באבחנה עלול למנוע מהם התחלת טיפול אנזימי ועקב כך, חלילה, סיבוכים בלתי הפיכים ונכות.
נתרכז בסוג 1 ו-3, שכן בתינוקות עם סוג 2 בכל מקרה ההידרדרות הקטלנית בלתי נמנעת, וכל שיש לעשות הוא למנוע סבל ולוודא כי בהריונות עתידיים יבוצע אבחון טרום לידתי יעיל, וקיימת גם אפשרות להסתייע באבחון טרום השרשתי (PGD).
כל מקרה של הגדלת טחול, במיוחד בנוכחות ירידה בספירות הדם, במיוחד הטסיות, חייב לכלול מחלת גושה באבחנה המבדלת. ככלל, אם יש אנמיה ניכרת ללא תרומבוציטופניה, הרי שגם אם ברקע יש מחלת גושה, אין היא הגורם לאנמיה. בדומה, הגדלת כבד ללא הגדלת טחול בולטת יותר חייבת לכוון לחיפוש מחלת כבד ראשונית. מובן שממצא של ירידה בטסיות גם בהעדר הגדלת טחול, במיוחד באשכנזים, צריך לכוון לבדיקת פעילות האנזים גלוקוצרברוזידאז.
בכל מקרה של פיגור בגדילה לגובה, בעיקר כשלכך נלווית אפילו הגדלה קלה של הטחול, יש להוסיף אבחון גושה לסוללת הבדיקות: בעידן הטרום-אנזימי היה ניתוח כריתת טחול מביא לזינוק בצמיחה לגובה, וכיום ניתן להשיג זאת על ידי הטיפול האנזימי. עיכוב במתן הטיפול עלול למנוע מהמתבגר(ת) לשפר T, אחוזוני הגדילה. כל מקרה של כאב עז בעצם, במיוחד מעל או מתחת לברך, בין אם מלווה בסימני דלקת (חום, ש"ד מוחשת, לויקוציטוזיס, נפיחות ואודם מקומי) או בין אם לאו, חייב לעורר מחשבה על מחלת גושה, שכן בניגוד לאוסטאומיאליטיס זיהומית, במצבים כאלה (המכונים "משברי עצם" או Bone crisis) עלול הניקוז הכירורגי להחדיר זיהום יותר מאשר לסייע. רמזים יבואו כמובן מתמונת הדם, בדיקת הטחול ו/או סיפור משפחתי.
אירוע גרמי אחר שעלול להיות התסמין הראשון (הגם שלא נפוץ) הוא אירוע של נמק אווסקולרי (AVN) של פרק גדול, במיוחד פרק הירך. כל מקרה של AVN חייב לכלול מחלת גושה באבחנה המבדלת, במיוחד בהעדר סיפור של טראומה או נטילת סטרואידים ובמיוחד אם מדובר בגיל צעיר (אבחנה מבדלת עם מחלת פרטס). גם עייפות ניכרת, יותר במבוגרים מאשר בילדים, צריכה להביא בחשבון מחלת גושה.
יש לזכור שפעמים רבות תהיה הבדיקה שלילית, אולם בהתחשב בכך שמדובר בבדיקת דם פשוטה (שבמקרים רבים מנסיוננו יכלה למנוע בירור מייגע, יקר ואף פולשני) עם השלכות טיפוליות מיידיות, הרי שחשוב לבצעה בכל פעם שהמחשבה על אודות מחלת גושה עולה ולא רק באשכנזים. כמובן, סיפור משפחתי מסייע לחשיבה על אודות מחלה גנטית.
הערכה ראשונית ומעקב תקופתי
ההערכה הבסיסית של מחלת הגושה כוללת בנוסף לאנמנזה ולבדיקה פיזיקלית שורה ארוכה של בדיקות מעבדה והדמיה: ספירת דם שלמה, ביוכימיה עם דגש על תפקודי כבד (בדרך כלל יהיו תקינים גם בנוכחות הגדלה מסיבית של הכבד), אימונוגלובולינים, פרופיל הפטיטיס, ברזל וויטמין B12, בדיקת אולטרסאונד למדידת גודל הטחול והכבד (או במידת האפשר בדיקת MRI, אך לא בילדים עקב הצורך בהרדמה, ולא CT עקב הקרינה), צילומי שלד ובמידת האפשר MRI של עמוד השדרה, האגן, פרקי הירכיים, ירכיים וברכיים. במבוגרים נציע גם בדיקת צפיפות עצם, בדיקת אקו-לב בסיסית להערכת לחץ הדם הריאתי ותפקודי ריאות.
בכל בדיקת מעקב נכלול בדיקת ביו-מרקים, שמביניהם החשובים הם הכיטוטריוזידאז וה-18-CCL שמהווים סמן מועדף להערכת פעילות המחלה. בעוד שהערך האבסולוטי פחות חשוב, הרי שעלייה משמעותית תכוון אולי לצורך להתחלת טיפול אנזימי, בעוד שירידה בפעילותם תשקף תגובה משביעת רצון לטיפולים השונים.
יש לציין כי לצילומי השלד הפשוטים יכולת מוגבלת להערכת מעורבות עצם בשלביה הראשונים, אך הם בהחלט משקפים סיבוכים בלתי הפיכים. בילדים, עקב החשיבות של הערכת הגדילה וההתפתחות, יש להקפיד על מעקב אחרי עקומות גדילה וניתן להוסיף צילום לקביעת גיל העצמות.
הצלחת המעקב אחרי מחלה נדירה יחסית, עם אפשרות פגיעה רב מערכתית, תלויה במידה רבה בהפניית החולים למרכז המתמחה במחלה והמשלב עבודת צוות הכוללת רופאים מפנימית, ילדים, המטולוגיה, רנטגן, אורטופדיה, גינקולוגיה ומיילדות, כירורגיה, קרדיולוגיה והרדמה. הניסיון שצברנו במשך יותר מ-18 שנה עם יותר מ-600 חולים במרפאת הגושה בשערי צדק אפשר לנו לא רק לספק שירות רפואי איכותי אלא גם לענות על שאלות שבעבר היו פתוחות, כגון: בטיחות הריון ולידה בחולות גושה עם או ללא טיפול אנזימי, זיהוי יתר לחץ דם ריאתי כבעיה ייחודית של מחלת גושה, עם או ללא קשר לטיפול האנזימי, משמעות ממצאי מעבדה דוגמת גמופתיה מונוקלונלית, הפגת החשש משיעור מוגבר כביכול של גידולים ממאירים בקרב חולי גושה, הקשר לתסמונת פרקינסון, זיהוי תת קבוצה של חולי גושה עם הסתיידויות קטלניות במסתמי הלב ובעורקים הגדולים ועוד.
הגישות הטיפוליות
אנזים חליפי - עד שנת 1991, שבה הוכנס לראשונה הטיפול האנזימי, היתה מחלת גושה חשוכת מרפא והטיפול שהוצע לחולים היה סימפטומטי בלבד, כגון כריתת הטחול (באופן שלם או חלקי) במצבים של הגדלה מסיבית או היפרספלנזים קשה (בדרך כלל עם נטייה לדמם ואנמיה משמעותית) וניתוחי תיקון אורטופדיים.
האנזים הראשון שהוכנס לשימוש הופק בתחילה משליות נשים (Alglucerase Ceredase®, Genzyme Corp) ובהמשך הופק באופן רקומביננטי (Imiglucerase Cerezyme®, Genzyme Corp. Cambridge MA).
הטיפול הוכח כיעיל ובטוח ביותר מ-4,000 חולים מטופלים עד היום בכל העולם. היעילות מתבטאת בהקטנת נפח הכבד והטחול, שיפור במדדים ההמטולוגיים, הפחתת כאבי העצמות ומניעת סיבוכים דוגמת AVN (כאשר הטיפול ניתן מוקדם בחולים בסיכון), שיפור בצמיחה לגובה בילדים, ואגב כל אלה, שיפור ניכר באיכות חיי המטופלים.
הטיפול ניתן בעירוי תוך ורידי במינונים ובתדירויות שונות, במרכזים שונים ברחבי העולם, אך קיימות מחלוקות בשאלת המינון האידיאלי. הטיפול בדרך כלל ניתן פעם בשבועיים למשך כל החיים. מלבד הצורך למתן האנזים לווריד, צריך להתייחס גם לנושא העלות הגבוהה של הטיפול (בין 100 אלף דולר ל-400 אלף דולר בשנה) המהווה אתגר למערכות הבריאות הנדרשות למימון עתק. כמו כן יש קושי בהשגת הטיפול לחולים ממדינות עניות, אם כי זה המקום לציין בחיוב את מדיניות היצרן למתן טיפול חינם למאות חולים מארצות אלו, לרבות באזורנו, לחולים השייכים לרשות הפלסטינית.
המינון הניתן כיום בארץ נחשב למינון נמוך של 15 יחידות לק"ג בכל עירוי, אם כי בילדים עם התבטאות קשה נהוג להתחיל במינון כפול מזה (30 יחידות לק"ג אחת לשבועיים). במרכזים אחרים, במיוחד בארה"ב, בגרמניה וביפן, המינון המקובל הוא 60 יחידות לק"ג לעירוי. התרשמותנו היא כי לא נצפתה יעילות פחותה בעלת משמעות קלינית בין התוצאות המתקבלות בחולים במינון הנמוך לבין אלו שמדווחות בהקשר למינונים גבוהים.
גם המועד לתחילת הטיפול עדין שנוי במחלוקת, למרות שעברו כבר למעלה מ-15 שנה מאז התחלת הטיפול. בעוד שלגבי חולים סימפטומטיים בעלי שינויים משמעותיים בגודל האיברים הפנימיים או בבדיקות מעבדה, אין מחלוקת אודות הצורך בהתחלת הטיפול, הרי שבמקרים הקלים ואף הא-סימפטומטיים קיימות דעות שונות.
למחברי הסקירה יש רתיעה מובנת מפני התחלת טיפול כרוני בילד או אדם צעיר שייתכן ולעולם לא יסבלו מביטויים של המחלה. בחולים אלה אנו מעדיפים לקיים מעקב קפדני, אשר יהיה יותר תכוף בקרב בעלי הפרוגנוזה הפחות טובה (מוטציות "רעות", אחאים עם מחלה מתקדמת), וההחלטה מתקבלת בהתאם להתקדמות הממצאים. המעקב כולל: עקומות גדילה בילדים, מדדים המטולוגיים וסמנים ספציפיים להתקדמות המחלה (CCL-18, Chitotriosidase). גם השאלה של הפסקת טיפול או חופשות מטיפול לאחר הגעה ליעדי הטיפול האופטימליים נתונה עדיין לדיון.
יש לזכור שהטיפול הנוכחי אינו חוצה את מחסום הדם-מח ולכן יעילותו מוגבלת רק לטיפול בביטויים הפריפריים של המחלה והוא אינו משפיע על הביטויים הנוירולוגיים המופיעים ב-Type 2 וב-Type 3.
בשנה זו מתקיימים שני ניסויים קליניים (שניהם בפאזה 3) עם שני אנזימים חדשים. חשיבות פיתוחם היא גם כלכלית (התקווה להקטנת עלות הטיפול) וגם ביצירת אופציה נוספת, במיוחד לאותם חולים, מעטים אמנם, שאינם מגיבים כפי שהיה רצוי לטיפול הקיים או שמפתחים תופעות לוואי או נוגדנים לטיפול הקיים.
התכשיר החדש הראשון הוא ה-GA-GCB, אנזים גלוקוצרברוזידאז המיוצר בהנדסה גנטית בתאיים אנושיים ואשר בשונה מהאנזים הקיים היום, ®Cerezyme, מכיל את רצף חומצות האמינו המדויק כפי שקיים באנזים הטבעי. יעילות האנזים, המיוצר על ידי חברת Shire Human Genetics Therapies, נמצאה גבוהה ב-11 חולים שטופלו ביחידת גושה בשערי צדק בניסוי קליני פאזה 1-2.
האנזים השני שבפיתוח הוא prGCB, המיוצר על ידי חברת פרוטליקס מכרמיאל. האנזים מיוצר בפלטפורמה ייחודית של תאי צמח, בטיחותו נבדקה בבעלי חיים וכן בשישה מתנדבים בריאים (פאזה 1). ה-FDA ויתר על הצורך בביצוע Phase II עקב התרשמות טובה מנתוני הבטיחות מ-Phase I, ובימים אלה עומד להתחיל ניסוי פאזה 3 רב מרכזי.
תכשירים מעכבי סובסטרט - התכשיר Zavesce® (Imimosugar N-butyl deoxynojirimycin, Miglustat) הוא מעכב של האנזים Glucosyltransferase, האנזים הראשון בשרשרת הייצור של הגליקוליפידים, ובכך מקטין את כמות הגלוקוצרברוזיד המשמש כסובסטרט לאנזים הפגוע במחלת גושה. הטיפול ניתן בכדורים והראה ירידה בנפח הכבד והטחול ועלייה בהמוגלובין וטסיות, אם כי לא בשיעור שנצפה בטיפול באנזים החליפי ®Cerezyme. תופעות הלוואי שהופיעו תחת טיפול היו שלשול, כאבי בטן וירידה במשקל, ובמספר קטן של חולים הופיעו תופעות נוירולוגיות כמו נוירופתיה פריפרית, רעד ופרסטזיות. הטיפול ניתן כיום לחולים בודדים בארץ, הוא רשום בפנקס התרופות אך אינו מאושר בסל.
תכשיר נוסף נמצא כעת בניסוי קליני Phase II, מיוצר על ידי חברת Genzyme ומבוסס על אנלוג של צראמיד כמעכב של האנזים Glucosyltransferase. הניסוי מתקיים במספר מרכזים בעולם, לרבות מרפאות הגושה בבית החולים שערי צדק ורמב"ם.
Pharmacological Chaperones - מדובר בגישה טיפולית חדשה, שבה המטרה היא לשפר את המבנה המרחבי, התנועה ואת הפעילות השאריתית של האנזים הפגום הקיים אצל החולים. הפוטנציאל הגלום בטיפול מסוג זה הוא היכולת לטפל בתופעות הנוירולוגיות, כיוון שמדובר במולקולה קטנה שחוצה את מחסום הדם-מח. לאחרונה דיווח היצרן (Amicus Therapeutics) על סיום מוצלח של נסיונות בטיחות במתנדבים (פאזה 1) וגיוס חולים לניסוי שלב 2.
השתלת מח עצם - שיטה זו נוסתה במספר קטן של מקרים ומטרת הטיפול היא לתרום לחולה תאי מקרופאג'ים תקינים ובכך לספק לו אנזים תקין בכמות מספקת. בקבוצה קטנה של ילדים שסבלה מגושה Type 3 נצפתה קפיצת גדילה, ירידה משמעותית בנפח הכבד והטחול ועלייה לנורמה ברמות פעילות האנזים בתוך שנה מזמן השתלת מח עצם אלוגנאית. עם זאת, לא נצפתה השפעה מיטיבה על היכולות הקוגניטיביות בקרב המושתלים. שיפור עתידי בבטיחות השתלות מח עצם או תאי גזע (דוגמת miniablation), שלא יעמידו את החולים בפני סכנות חיים משמעותיות, עשוי להחזיר גישה טיפולית זו, כמו גם במחלות גנטיות אחרות.
טיפול גנטי - הצלחת אותם מקרים בודדים של השתלת מח עצם היוותה אינדיקציה לאפשרות השימוש בהשתלת גנים (Gene therapy) במחלת גושה. נסיונות בודדים שנעשו בחולי גושה לא צלחו, אולם לאחרונה, עם פיתוח מודלים מתאימים של עכבר ובמקביל להצלחות במחלות אחרות, יש מחקרים חדשנים בכיוון, שבמידה שיישאו פרי, ניתן יהיה לרפא מחלה תורשתית זו כמו רבות אחרות בטיפול שעשוי להיות חד פעמי.
סקר גנטי לאיתור נשאים
בעשור האחרון נוהגים המכונים הגנטיים בארץ להציע בדיקת סקר (טרום לידתי או לפני הריון) לזיהוי נשאי או חולי גושה, במסגרת מה שמכונה "החבילה האשכנזית" של מחלות גנטיות לזוגות צעירים ממוצא אשכנזי. הכללה של מחלה לא קשה (בדרך כלל) וברת טיפול עמדה בסתירה להנחיות ארגון הבריאות העולמי וכמו כן בניגוד להמלצות משרד הבריאות והמועצה הלאומית לגנטיקה. הסקר גרם לגילוי של נשאים רבים (כזכור, 1 מ-17 אשכנזים צפוי/ה להיות נשא/ית של המחלה) ובמקרים לא מעטים הביא להפלות של מי שעשויים היו להיות חולי גושה אסימפטומטים. במקרים רבים עוררו ממצאי הבדיקה חרדות ודאגות שווא להורים העתידיים.
הבדיקה הנמצאת בשימוש רחב עדיין יכולה לזהות מספר קטן (שש עד שמונה) מהמוטציות השכיחות באוכלוסיה האשכנזית, והיא אינה נותנת מענה למוטציות הנדירות שיכולות להופיע גם בקרב מיעוט מהאשכנזים וחלק מהלא-אשכנזים והנושאות בחובן את הסיכון דווקא לצורות הנוירונופתיות של גושה, שם יש חשיבות לגילוי המוקדם. למרות הסתייגות המחברים מהכללת גושה בבדיקות הסקר, עומדת להתפרסם בקרוב עבודת מחקר שתגלה כי קיימת שביעות רצון מביצוע בדיקה זו בקרב אותם זוגות צעירים אשר אותרו כנשאים, ולפיכך שאלת הסקר למחלה שיכולה להיות קלה ביותר נותרה פתוחה.
היבטים חברתיים נוספים
מחלת גושה מהווה מודל לא רק לקשר בין גנוטיפ לפנוטיפ ולגישות טיפוליות במחלות גנטיות, אלא גם נחשבת למודל להתמודדות מערכות הבריאות עם עלויות העתק של תרופות למחלות נדירות. הקצאת סכומים בסדרי גודל של עשרות מיליונים לציבור קטן של חולים (בארץ, מעל 80 מיליון שקל לשנה לפחות מ-200 חולי גושה) מעוררת תהיות לגבי הצדק של ניצול משאבים מוגבלים לכלל האוכלוסיה, כאשר מנגד אין לקפח את זכותם של חולים במחלות נדירות לקבל טיפולים מצילי חיים או משפרי איכות חיים רק בגלל שכיחות מחלתם. במדינת ישראל קבע החוק מתן הקצאת כספים ייעודית לטיפול במחלות קשות ("יקרות") ובמקרה הספציפי של גושה, הוקמה ועדה של משרד הבריאות לאישור הצדקת הטיפול בהתאם לקריטריונים שנקבעו על ידי מומחים במחלה, וגם כאן מחקר שנערך לאחרונה הוכיח שביעות רצון גם של החולים מגישה זו.
לסיכום: מחלת גושה מדגימה את יישום ההצלחה המחקרית לטובת החולה ובני משפחתו: שיפור יכולת האבחנה וזיהוי הנשאים, זמינות של טיפול אנזימי יעיל (אך עם מגבלות של עלות ושל מתן תוך ורידי) לצד פיתוח תכשירים פומיים חדשים (מעכבי סובסטראט ושפרונים פרמקולוגיים) ותקוות לעתיד של ריפוי באמצעות השתלת גנים או תאי גזע. כל אלה עשויים להוות מודל התייחסות למחלות אחרות, תורשתיות ונרכשות. שכיחותה הגבוהה יחסית של מחלת גושה בקרב האוכלוסיה האשכנזית מוסיפה נדבך נוסף לחשיבות ההיכרות של הרופאים בישראל עם מחלה זו.
הפמור המרוחק אצל חולה בן 38. הרחבה מטפיזרית אופיינית בצורת בקבוק ארלנמייר ושינויים ציסטיים במוח העצם. ממצא אופייני בחולי גושה.
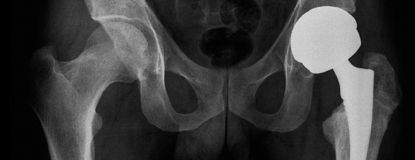
צילום אגן המדגים מצב לאחר החלפת מפרק הירך השמאלי בעקבות נמק של ראש הפמור והרס מפרק הירך. מימין המפרק לא נפגע כלל.
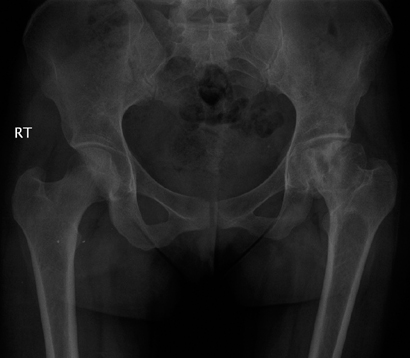
צילום אגן של חולת גושה צעירה עם נמק א-וסקולרי של ראש פמור שמאל ושינוים שחיקתיים של מפרק הירך. מפרק הירך השני תקין ומבנה העצמות האחרות ללא כל עדות למחלת הגושה.
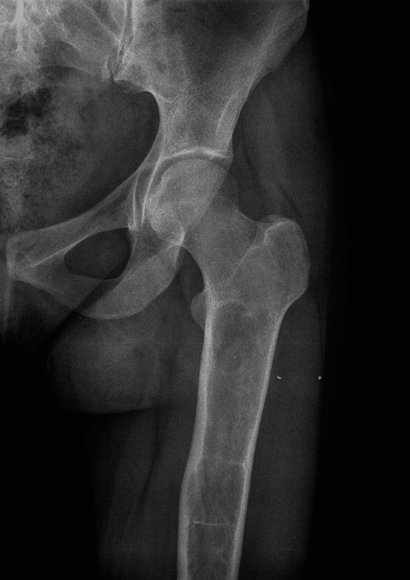
הפמור המקורב. הרחבה מודלרית כביטָוי למילוי מוח העצם בתאי גושה. שימו לב להעדר פגיעה בראש הפמור.
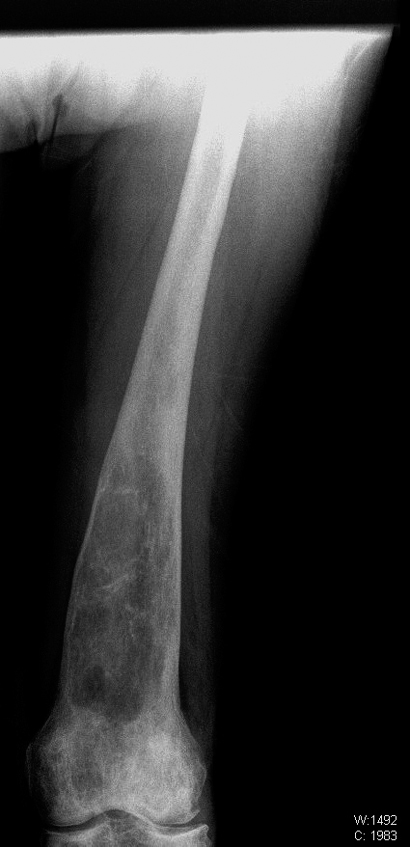
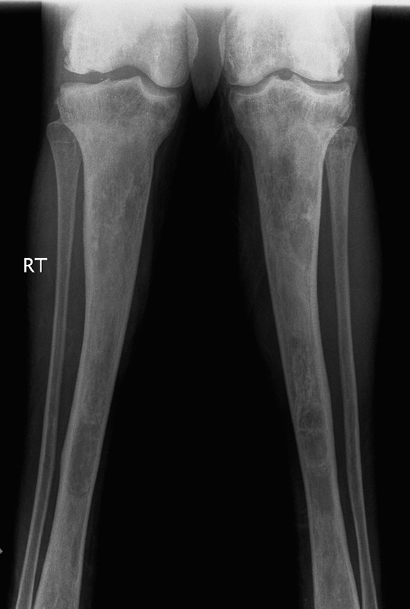
הרחבה מטפיזרית של הטיביות, (מצב נדיר יחסית במחלת הגושה) ממצא דומה לזה שניתן לראות במקרים רבים בפמור. שימו לב לשינויים ציסטיים והיפר-דנסיים במדולה, כביטוי לאוטמים שאירעו בגיל מוקדם. המשטח המפרקי בברך פגוע ויש אוסטיופניה קשה.
(רשימה ביבליוגרפית מלאה שמורה במערכת)
ד"ר מיכי פיליפס ופרופ' ארי זימרן, מרפאת גושה, המרכז הרפואי שערי צדק