המוח האנושי בנוי ממיליארדי תאים, שמאורגנים ברשתות מסועפות שאחראיות לתפקודו המורכב. אם בעבר שלטה הגישה לפיה המוח הבוגר הוא איבר חסר יכולת התחדשות, הרי כיום ידוע שהמוח הבוגר מכיל תאי אב מולטיפוטנטיים, אשר בתגובה לאותות סביבתיים מסוגלים להתמיין לשלוש השורות של מערכת העצבים: נוירונים, אסטרוציטים ואוליגודנדרוציטים.
בעקבות גילוי תאי האב נמצא גם שבמערכת העצבים המרכזית של יונקים יש תהליך של נוירוגנזה באזורים מוגדרים של המוח כגון ההיפוקמפוס ומערכת הריח, המתרחשת במהלך כל החיים. תגליות מהפכניות אלו העידו על הפלסטיות של המוח הבוגר, אשר עשוי בתנאים מסוימים לעבור רגנרציה, על ידי תאי אב אנדוגנים או על ידי השתלת תאים. הזיהוי של תאי אב נויראליים יצר תקוות שנוכל להשתיל תאים למוח ולחוט השדרה על מנת להחליף תאים ורקמה שניזוקו במצבי מחלה שונים.
טיפול תאי במחלות נוירודגנרטיביות
במחלות ניווניות שונות של מערכת העצבים מתרחש מוות של תאים השייכים למסלולים או למערכות עצביות ספציפיות. מחלת אלצהיימר מאופיינת באיבוד נוירונים וקשרים סינפטיים ומערבת את המערכת הכולינרגית במוח הקדמי, אמיגדלה, היפוקמפוס וקליפת המוח. קיימת ירידה פרוגרסיבית בזיכרון ובתפקודים הקוגניטיביים והחולים מפתחים דמנציה. הטיפול כיום הוא סימפטומטי וכולל מעכבים של אצטיל-כולינאסטרזות שמגבירים את תפקוד המערכת הכולינרגית, אך הם עוזרים רק באופן חלקי וזמני. טיפול תאי יצטרך לשמר או להחליף תאי עצב בעלי מומחיות שונה ובאזורי מוח שונים, כולל קישורים מורכבים.
טיפול תאי נראה ריאלי יותר במחלת פרקינסון, שבה התהליך הניווני מוגבל בעיקר לתאים דופמינרגיים בסובסטנסיה ניגרה. המחלה מתבטאת בנוקשות שרירים, איטיות פסיכומוטורית, רעד והפרעות הליכה. הטיפולים כיום מתבססים בעיקר על מתן תכשירי L-dopa, ההופכים במוח לדופמין, או אגוניסטים לרצפטורים דופמינרגיים, היעילים רק לחלק מהסימפטומים אך בעלי תופעות לוואי רבות ואינם עוצרים את הידרדרות המחלה. השתלת תאי עצב דופמינרגיים לגרעיני הבסיס עשויה להשפיע על חלק ניכר מסימני המחלה.
דוגמה נוספת למחלה ניוונית הפוגעת באזור ספציפי בגרעיני הבסיס היא מחלת הנטינגטון, המתאפיינת בכוריאה (תנועות לא רצוניות) ודמנציה פרוגרסיבית. אין למחלה טיפול ספציפי. ב-Amyotrophic Lateral Sclerosis) ALS) מתרחש ניוון נוירונים מוטוריים בחוט השדרה וכן בקליפת המוח ובגזע המוח, הגורם להידרדרות מהירה בכוח השרירים עד כדי שיתוק גפיים, שיתוק שרירי דיבור, בליעה ונשימה עם מוות תוך מספר שנים. למחלה זו לא קיים כל טיפול אפקטיבי וטיפול תאי יכוון הן לתאי העצב המוטורים הספינליים והן הקורטיקליים.
גם במחלות מוח אחרות אין בנמצא כל טיפול רגנרטיבי. כך למשל, בשבץ מוחי נגרם נמק של רקמת מוח כתוצאה מחסימת כלי דם, שמביא להגבלות מוטוריות, תחושתיות וקוגניטיביות. מוות תאי המוח במקרה זה אינו ספציפי למערכת או למסלול, אלא של כל הנוירונים ותאי הגליה אשר בפיזור כלי הדם שנחסם. מחקרים שונים הראו שטיפול שיקומי אינטנסיבי לא רק שהוא מחזק שרירים היקפיים, אלא גם מגדיל את הייצוג המוחי לתפקוד המוטורי או המנטלי שנפגע באוטם. ממצא זה מחזק את הגישה לפיה המוח הבוגר הוא פלסטי ובעל פוטנציאל לרגנרציה תאית בתנאים הנכונים.
טרשת נפוצה היא מחלה שמתווכת על ידי תהליך דלקתי שפוגע בתאים יוצרי המיאלין, כך שנוצרת דמיאלינציה, המובילה לפגיעה בהולכה העצבית וכתוצאה מכך לנזק תפקודי משמעותי. גורם חשוב להידרדרות התפקודית היא פגיעה באקסונים בזמן הדלקת החריפה או בעקבות דמיאלינציה כרונית. מחקרים הראו קיומם של תאי אב לאוליגודנדרוציטים במוח הבריא והחולה (תמונה מס' 1).
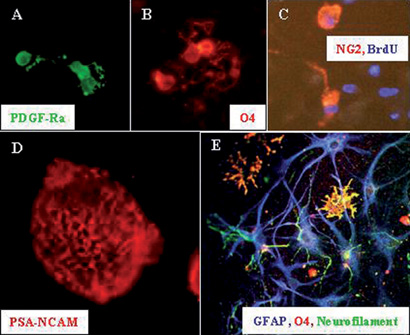
תמונה 1
תאי אב של מערכת העצבים המרכזית:
A-C: תאים פרוגניטורים לאוליגודנדרוציטים, אשר בודדו מתוך מוח אדם בוגר וגודלו בתנאי תרבית, מבטאים סמנים שונים, כולל הרצפטור ל- Platelet derived growth factor (A), הסמן (B) O4, והפרוטאוגליקן C ) NG2, באדום). תאים אלה מסוגלים להתרבות, כפי שמודגם על ידי קליטת BrdU לדנ"א (C, בכחול). אלה התאים שתפקידם לשחזר את מעטפות המיאלין במוח
D-E: נוירוספירות שגדלות מתאי אב שהופקו ממוח מכרסם יילוד המבטאות את הסמן PSA-NCAM, אשר מקנה לתאים תכונות של נדידה ורגנרציה (D). נוירוספירות אלו מתמיינות בתנאי תרבית לשלוש שורות תאי המוח, כולל נוירונים (ירוק), אוליגודנדרוציטים (אדום) ואסטרוציטים (כחול) (E).
בשלבים מוקדמים של המחלה מתרחשת רמיאלינציה אנדוגנית ספונטנית, אך היא מוגבלת ונכשלת בסופו של דבר. לכן יש צורך בפיתוח טיפול תאי להשריית רמיאלינציה גם במחלה זאת.
הצלחת הטיפול התאי תלויה בגורמים רבים. ראשית, כיוון שבמחלות ניווניות שונות נפגעות אוכלוסיות תאים שונות, יש צורך להשתיל בכל מחלה סוג מסוים של תאים: תאים דופמינרגיים במחלת פרקינסון, תאים מוטוריים ב-ALS, תאים כולינרגיים ואחרים באלצהיימר ואוליגודנדרוציטים בטרשת נפוצה. בנוסף, כמה מהמחלות, כמו טרשת נפוצה, אלצהיימר ו-ALS, הן מחלות מפושטות או רב מוקדיות ובלתי אפשרי לבצע השתלות לכל לזיה בנפרד, ולכן תנאי חשוב הוא יכולת התאים המושתלים לנדוד במוח המושתל. זאת ועוד, היות שרוב המחלות הללו הן כרוניות, הרי תנאי נוסף להצלחת הטיפול הוא יכולת הישרדות ארוכת טווח של התאים במוח המאכסן. תנאים אלה הם קשים להשגה כיוון שנוירונים ואוליגודנדרוציטים ממוינים אינם מסוגלים לנדוד ושרידותם במוח הבוגר נמוכה מאוד.
הפתרון טמון בתאי גזע
תאי גזע הם תאים בעלי יכולת התחדשות בלתי מוגבלת ויכולת להתמיין למגוון סוגי תאים, אשר כולם צמחו משבט שמקורו בתא גזע אחד. תאי גזע עובריים (Embryonic stem cells) מופקים מעוברים צעירים מאוד מה-Inner cell mass של הבלסטוציסט. אלה תאים טוטיפוטנטים, שמסוגלים להתמיין לרפרטואר של כלל תאי הגוף. ניתן לייצר שורות תאי גזע עובריים מכל היונקים ולגדלם בתרבית ללא הגבלת זמן, תוך שמירה על קריוטיפ תקין וטוטיפוטנטיות.
נמצא שניתן לכוון תאי גזע עובריים עכבריים ואנושיים בתרבית לתאי אב נויראליים ולהשרות התמיינותם לשורות ספציפיות, כולל נוירונים מוטוריים, נוירונים דופמינרגיים, נוירונים תחושתיים ותאים אוליגודנדרוגליאליים, באמצעות שימוש בגורמי גדילה, באופן שמחקה את ההתפתחות העוברית. ניתן גם לגדל תאי אב נויראליים מתוך מערכת העצבים של העובר ואף מן המוח לאחר הלידה ובחיים הבוגרים (תמונה מס' 1). תאים אלה מסוגלים להתמיין לשלוש השורות של תאי מערכת העצבים המרכזית, אך יכולתם ליצור אוכלוסיות ספציפיות של תאי עצב כנראה מוגבלת יותר. תאי אב נויראליים של עכבר ואדם (שהופקו מתאי גזע עובריים או מתוך המוח) הושתלו למערכת העצבים המתפתחת של עכברים והגיבו לסיגנלים ההתפתחותיים הנורמליים בנדידה והתמיינות בהתאם לשלב ההתפתחותי של המוח באותו זמן.
ממצא זה מחזק את הגישה המעודדת שימוש בתאים אלה לצורך השתלה בחולים. גם רקמות אחרות מכילות תאי אב המהווים מקור להתפתחות והתחדשות הרקמה. במח העצם, למשל, נמצאים תאי אב המטופוייטים וכן תאי סטרומה (תשתית), שהם תאי אב מזנכימליים המסוגלים לייצר רקמת סחוס ועצם. היתרון של תאי גזע מזנכימליים היא האפשרות להפיקם מן החולה ולהחזירם אליו כהשתלה אוטולוגית.
עם זאת, נושא מרכזי וקונטרוברסלי בתחום של תאי גזע הוא היכולת הפלסטית של תאי גזע מרקמה אחת ליצור תאים של רקמה אחרת. מחקרים רבים הראו שהתאים המזנכימליים מסוגלים לבטא מאפיינים שונים של מערכת העצבים, אך עדיין לא הצליחו להוכיח התמיינות מלאה שלהם לתאי עצב פונקציונליים (טרנס-דיפרנציאציה שלהם לתאים נוירו-אקטודרמליים) כדי לשמש כמקור של תאים להשתלה לצורך רגנרציה תאית במוח.
התא האידיאלי להשתלה צריך להיות מסוגל להתמיין לאוכלוסיית התאים הדרושה במחלה הספציפית, בעל יכולת נדידה (תמונה מס' 2) ויכולת הישרדות ארוכת טווח. לאור דרישות אלו, תאי גזע עובריים ותאי גזע נויראליים מייצגים עדיין את המקור הטוב ביותר לגישה טיפולית של החלפת תאים פגועים במערכת העצבים המרכזית. הסכנה הפוטנציאלית העיקרית בהשתלת תאי גזע עובריים היא בהתפתחות גידולים. תאי גזע עובריים, מעצם הגדרתם, יכולים ליצור טרטומות לאחר השתלה. אולם, לאחר שתאי הגזע כוונו להיות תאי אב נויראליים, לא נצפו גידולים לאחר השתלתם.
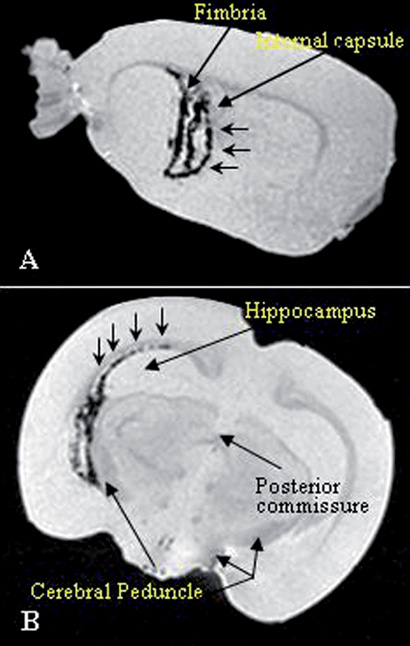
תמונה 2. נדידה של תאי אב נויראליים במוח של חולדה שבה הושרתה דלקת אוטואימונית (EAE), כמודל לטרשת נפוצה. התאים סומנו על ידי חומר פרה-מגנטי, המאפשר את זיהויים במוח לאחר ההשתלה בשיטת MRI. התאים הושתלו לחדרי המוח ונדדו במסלולי החומר הלבן המודלקים (חצים קצרים).
מנגנוני פעולה של תאי גזע מושתלים
המנגנונים בהם תאים מושתלים משפיעים על ריפוי המוח עדיין לא ברורים לחלוטין. השתלת תאים נויראליים התרכזה עד לאחרונה בפוטנציאל שלהם להחליף את אוכלוסיית התאים הפגועה. הוכחה ראשונה לכך שהחלפת תאים עובדת במוח האנושי ניתנה בחולי פרקינסון שבהם הושתלה רקמה מזנצפאלית עוברית אנושית, העשירה בתאים דופמינרגיים. התאים עברו אינטגרציה מלאה במוח המארח והביאו לשיפור תפקודי אצל חלק מהחולים. אך הצורך ברקמה, המופקת משמונה עוברים מופלים בשביל כל חולה פרקינסון, כרוכה בקשיים אתיים וטכניים מרובים. יתר על כן, השונות בכמות ובאיכות הרקמה העוברית המיועדת להשתלה מונעת סטנדרטיזציה של הטיפול. לכן, השתלת רקמה עוברית היוותה מעין Proof of principle לפוטנציאל הטיפולי בהשתלת תאים, אך בלתי סבירה מבחינה קלינית.
היכולת לייצר נוירונים דופמינרגיים בתרבית מתאי גזע העלתה את התקווה שתאים אלה יהוו תחליף להשתלת רקמה עוברית מהפלות. המחקר בתחום זה עדיין עוסק בשיפור השרידות של התאים הדופמינרגיים בפעולת ההשתלה בחיות המעבדה ובהדגמת יכולתם להשתלב ברקמה מבחינה אנטומית, ליצור את הקשרים המתאימים בסטריאטום, להפריש דופמין במוח ולהביא להחלמה מסימני המחלה רק בסיום שלב מחקרי זה אפשר יהיה להתקדם לניסויים פרה-קליניים וקליניים.
השתלת תאים ב-ALS לצורך רגנרציה היא מורכבת עוד יותר, כיוון שהנוירונים המוטוריים המתנוונים במחלה זאת מפוזרים לכל אורך חוט השדרה ובקליפת המוח. עם זאת, הצליחו להראות שנוירונים מוטוריים ספינליים, שנוצרו בתרבית מתאי גזע עובריים של עכבר, יצרו סינפסות תפקודיות עם סיבי שריר בתרבית ושלחו אקסונים לשורשים הוונטרליים לאחר השתלתם בחולדות בוגרות. עדיין לא נמצא שנוירונים אלה מסוגלים לעבור אינטגרציה למעגלים הנויראליים ולשחזר תפקוד מוטורי.
יכולת מיאלינציה של תאי גזע נויראליים וגם תאי אב אוליגודנדרוגליאלים, שמקורם מתאי גזע עובריים שגודלו בתרבית, הודגמה במוחות של עוברי חולדות ועכברים עם דיס-מיאלינציה מולדת עקב מוטציה גנטית וכן במודלים לדמיאלינציה כימית מקומית. עדויות שונות הראו שהנכות התפקודית בעקבות פגיעות טראומתיות של חוט השדרה קשורה בחלקה לתהליך דמיאלינציה מתקדם לאחר הפגיעה החריפה. תאי גזע נויראליים אנושיים, שהושתלו לחוט שידרה פגוע של עכבר, יצרו נוירונים ואוליגודנדרוציטים חדשים ונמצאה קורלציה טובה בין מספר האוליגודנדרוציטים שמקורם מהשתל, מידת המיאלין ומידת השיפור התפקודי. לאור הנכות הקשה לאחר חבלות עמוד שדרה והעדר טיפול רגנרטיבי אחר, נראה שהשתלת תאי אב נויראליים ואוליגודנדרוגליאליים תיושם בעתיד הלא רחוק בחולים אלה. יחד עם זאת, יש לזכור שקיים סיכון מסוים להתמיינות אסטרוציטרית והנצה אקסונלית לא מאורגנת, שיכולה ליצור רגישות יתר לגירויים שבאופן נורמלי אינם אמורים להכאיב.
מכאן ברור כי תאי גזע יכולים להשפיע על המוח המושתל דרך התמיינות והחלפת התאים הפגועים (תמונה מס' 3). בנוסף, עדויות מצטברות, בייחוד במודלים של מחלת פרקינסון, פגיעות חוט שדרה, פגיעות מוח ובמחלת ALS, תומכות בהיפותזה שרגנרציה של מערכת העצבים המרכזית מואצת על ידי השתלת תאי גזע נויראליים באמצעות מנגנוני הגנה ותיקון אנדוגניים. תאי גזע נויראליים מייצרים מגוון של פקטורים נוירוטרופיים, כגון: Fibroblast growth factor 2, Glial cell derived neurotrophic factor, Neurotrophin-3, brain-derived neurotrophic factor, ועוד רבים אחרים, שיכולים להגן על המוח מפני פגיעה. הוצע שתיקון אנטומי וביוכימי ושיפור הסימפטומים ההתנהגותיים לאחר השתלת תאי גזע עובריים במודל של מחלת פרקינסון עשוי להיות קשור לאפקט טרופי על הנוירונים הדופמינרגיים הפגועים, שתרם להצלת הנוירונים שאינם מתפקדים במוח.
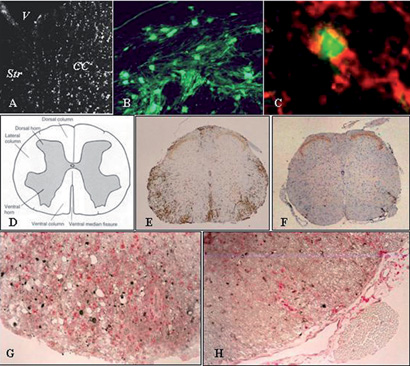
תמונה 3. עיכוב הדלקת המוחית על ידי השתלת תאי אב נויראליים:
A-C: תאי אב פלואורסצנטים הושתלו לחדרי המוח של מכרסמים עם EAE. הם נדדו מתוך החדר (V) למסלולי חומר לבן מודלקים, כגון הקורפוס קלוסום (CC), אך לא לאזורי חומר אפור, כגון הסטריאטום (Str)(A,B). חלק מן התאים התמיינו לאוליגודנדרוציטים המבטאים (C) Galactrocerebroside (באדום) וקו-לוקליזציה לסמן הפלואורסצנטי (בירוק).
D-H: עיכוב התהליך הדלקתי במוח על ידי השתלת תאי האב. סכימה של חתך רוחב של חוט השדרה של העכבר (2) מראה את החומר האפור במרכז ואת מסלולי החומר הלבן בהיקף. התהליך הדלקתי בחוט השדרה של עכבר עם EAE עשיר מאוד בתסנינים של לימפוציטים (E, חום). בחוט השדרה של חיות שעברו השתלת תאי אב נוירלים יש הפחתה ניכרת בכמות התסנינים (F). כמו כן, התהליך הדלקתי עשיר במיקרוגליה (G, אדום) אשר מעורבים בגרימת נזק אקסונלי חריף (שחור). בחיות המושתלות יש הפחתה ניכרת בתסניני המיקרוגליה ובנזק האקסונלי (H)
החלפת התאים הפגועים ב-ALS נראית מטרה רחוקת טווח, אך ניצול תאי גזע למניעת מוות של תאים מוטוריים נראית גישה ישימה יותר לטווח הקרוב. הגישה הזאת נתמכת בעבודות שונות שהראו שתאי גזע עובריים אנושיים שהושתלו לנוזל השדרה בחולדות עם פגיעה בנוירונים המוטוריים, התפזרו לאורך חוט השדרה, נדדו לתוך הרקמה והשרו החלמה מוטורית של החיות המשותקות. במקרים אלה נמצא שההתמיינות הנוירונאלית ומידת יצירת הנויריטים לא יכלו לתרום כל כך לשיפור התפקודי. הוצע שהתאים המושתלים הגנו על הנוירונים המוטוריים ברקמה המושתלת ממוות, האיצו רה-אפרנטציה שלהם ושחזרו את התפקוד הנוירולוגי.
גם במודל של מחלת הנטינגטון בחולדות נמצא שהשתלה מוחית של תאי גזע נויראליים אנושיים הפחיתה הגבלות מוטוריות באמצעות מנגנונים טרופיים. בנוסף, הודגם שהשתלת תאי גזע נויראליים, דרך שרוול ביולוגי לחוט שדרה חתוך למחצה של חולדה בוגרת, הביאה לשיפור משמעותי בתנועה, הודות להפחתת התהליך הנקרוטי ברקמה והגנה מפני מוות תאי, דלקת ויצירת צלקת גליאלית. גם במקרה זה נצפתה רגנרציה של נויריטים שמקורם מהרקמה המאכסנת. גם לאחר שבץ מוחי במכרסמים השתלת תאי גזע ממקורות שונים הביאה לתוצאות קליניות חיוביות. ברוב המקרים השתל יצר אפקט טרופי שהגביר את הישרדות התאים האנדוגניים ושמר על תפקודם.
לאחרונה הועלתה השערה כי תאי גזע ותאי אב נויראליים הפועלים באמצעות מנגנון אנטי דלקתי כדי להגן על רקמת מוח חולה.השתלת תאי אב נויראליים למערכת חדרי המוח עיכבה את המהלך הקליני והפתולוגי ב-EAE (
experimental autoimmune encephalomyelitis), המודל הניסויי של טרשת נפוצה. נמצא שההשתלה הפחיתה את עוצמת התהליך הדלקתי במוח, וכתוצאה מכך הוקטן באופן משמעותי הנזק הרקמתי בדמות הדמיאלינציה והפגיעה האקסונלית (תמונה מס' 3).
לאחרונה הודגם שהזרקה תוך ורידית של תאי אב נויראלים ב-EAE אף מנעה את הדלקת המוחית והנזק הרקמתי מבלי שהתאים המוזרקים חדרו למוח, אלא על ידי אפקט אנטי-דלקתי סיסטמי. בתנאי תרבית הודגם שתאים אלה מעכבים את האקטיבציה והפרוליפרציה של לימפוציטים מסוג T. ממצאים אלה רלבנטיים לטיפול תאי עתידי בטרשת נפוצה היות שהתהליך האוטואימוני הוא מרכיב מרכזי בפגיעה הרקמתית, עיכוב מקומי שלו על ידי השתלת תאים מפחית את התוצאות הפתולוגיות והקליניות המזיקות של המחלה.
אפקטים אנטי דלקתיים תוארו גם לגבי שורות של תאי גזע עובריים ותאי גזע מזנכימליים, שהם בעלי תכונות טרופיות ואימונומודולטוריות חזקות, והשתלתם הביאה לשיפור תפקודי במודלים של EAE ובפגיעות טראומתיות של חוט השדרה. לנושא הזה יש חשיבות רבה בגישה של השתלת תאים במחלות נוירודגנרטיביות המתווכות על ידי תהליך דלקתי, היות שהפחתה במידת התהליך הדלקתי יכולה גם להגן על השתל מפני התקפות אימוניות עתידיות.
לסיכום: מהו העתיד בתחום של השתלות תאי גזע במחלות נוירודגנרטיביות? התקדמות המחקר מחזקת את התקווה שניתן יהיה לפתח אסטרטגיה של השתלות תאים לשם שחזור תפקודי של המוח וחוט השדרה. לפני יישום הגישה הטיפולית הזו בחולים, חובה להראות את היעילות הטיפולית של התאים המושתלים במודלים בבעלי חיים שקרובים ככל האפשר מבחינה פתולוגית וקלינית למחלה בבני אדם. יש לחתור להבנה טובה יותר כיצד להשפיע על הסביבה הפתולוגית, כולל על התהליכים הדלקתיים, שמהווים גורם או תוצאה של המחלות השונות, כדי לאפשר תיקון עצבי.
כדי להביא את הטכנולוגיה של השתלת התאים לכדי יישום קליני יהיה צורך בקביעת קריטריונים לבחירת החולים המתאימים להשתלה; חשוב לפתח שיטות הדמיה שיאפשרו זיהוי מדויק של האזורים הנדרשים להשתלה ושיטות הדמיה למעקב אחרי התאים המושתלים ובנוסף יש צורך בפיתוח טכנולוגיות להפחתת תופעות הלוואי הבלתי רצויות של השתלה, כגון יצירת גידולים או יצירת מעגלים נוירונאליים שמובילים לרגישות יתר.
ד"ר אופירה אינשטיין, פרופ' תמיר בן חור, המחלקה לנוירולוגיה, המרכז הרפואי האוניברסיטאי הדסה