|
הנתונים המצטברים כיום מצביעים על מגמה ברורה של הארכת תוחלת החיים במדינות המערב ובהן גם ישראל. אולם, עם העלייה בתוחלת החיים אנו נחשפים למחלות תלויות גיל, כמו שיטיון (דמנציה) ושבץ מוח.
בשנים האחרונות הושקעו מאמצים רבים בהבנת הקשר בין שבץ מוח לשיטיון, אך תרומת אוטמים מוחיים לירידה קוגניטיבית ולשיטיון במבוגרים עדיין אינה ברורה.
מחלות כלי דם של המוח ושיטיון הם בין המחלות השכיחות ביותר בעולם המערבי1, כאשר שבץ מוח נמצא בין גורמי התמותה הראשונים וגורם עיקרי לנכות ארוכת-טווח ולפגיעה גופנית, נפשית וכלכלית. למעלה מ-15,000 מקרי שבץ מוח מדווחים מדי שנה בישראל והשכיחות עולה עם הגיל. כ-20 אחוז מהם מסתיימים במוות בתוך 3 חודשים. כ-35 אחוז מהשורדים מחלימים, אך כ-45 אחוז מהם יישארו מוגבלים ברמות שונות.
הפגיעות הנוירולוגיות שונות וכוללות חסרים מוטוריים, רגשיים, קוגניטיביים, תקשורתיים ובדרך כלל שילוב שלהם.
המונח "פגיעה קוגניטיבית ווסקולרית" הוצע כאבחנה כוללת לפגיעה קוגניטיבית בדרגות שונות כתוצאה ממחלת כלי דם של המוח, הנעה בין פגיעה קוגניטיבית קלה (MCI) לשיטיון וסקולרי .(VaD) מחלת אלצהיימר ושיטיון וסקולרי הם גורמים שכיחים לשיטיון וצפויים לפגוע במספר גדל והולך של חולים בעשורים הבאים2. רוב הדיווחים בספרות מתמקדים במחלות אלו כשתי פתולוגיות נפרדות אך גוברות העדויות לכך, שפגיעות מוח הקשורות בכל אחת מהפתולוגיות הללו, מופיעות לעיתים קרובות יחד, בעיקר בחולים מבוגרים3.
מספר מחקרים הראו, שאוטמים מוחיים מעלים את הסיכון לפגיעה קוגניטיבית ולשיטיון5,4, אולם הדרך בה גורמים האוטמים לפגיעה הקוגניטיבית עדיין אינה ברורה לחלוטין. כיוונים אפשריים כוללים את מיקום ומספר האוטמים. מחקר חדש, שהתפרסם רק לאחרונה, גורס שהשילוב של אוטמים במספר טריטוריות הוא מנבא חזק לפגיעה קוגניטיבית6.
החוקרים מצאו, שהימצאות אוטמים קורטיקליים או תת-קורטיקליים נקשרה בפגיעה בזיכרון. שילוב של אוטמים בשתי הטריטוריות מאט את מהירות העיבוד ופוגע בתפקודים ניהוליים, בעוד ששילוב של אוטמים צרבלריים ותת-קורטיקליים מאט רק את מהירות העיבוד. ממצאים אלה היו בלתי תלויים בפגיעה בחומר הלבן, באטרופיה של המוח ובתסמיני דיכאון. תוצאות המחקר מצביעות אולי על כך, שהמוח המזדקן חסר מנגנוני פיצוי מספיקים על פגיעה קוגניטיבית, המאפשרים את הגמישות ותיקון הנזקים לאחר היארעות אוטמים, כאשר הם מתרחשים במספר טריטוריות.
גורמים שעלולים לתרום לירידה ביכולת הפיצוי של המוח על פגיעה קוגניטיבית הם גיל, דלקת במוח, דיכאון ופגיעות בחומר הלבן. כל אלה עלולים להפוך את המוח לפגיע יותר לנזק נוסף של אוטם ונוכחותם לפני שבץ מוח עלולה לתרום משמעותית לפגיעה קוגניטיבית אחריו.
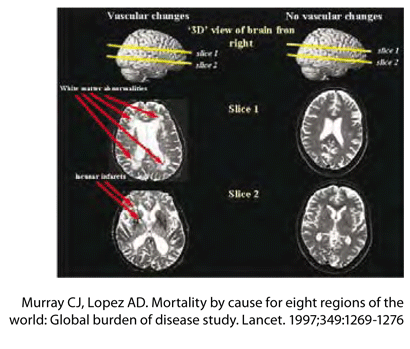
פגיעות בחומר הלבן נקשרו זה זמן רב בירידה קוגניטיבית וקיומן הוא חלק מקריטריוני האבחנה לשיטיון וסקולרי7. פגיעות אלו עולות עם הגיל והן כנראה בעלות אטיולוגיה וסקולרית. נזקים וסקולריים נחשבים כממלאים תפקיד חשוב בפתוגנזה של שיטיון וסקולרי, כמו גם של מחלת אלצהיימר8.
התפקודים הקוגניטיביים הנפגעים ביותר כתוצאה מפגיעות בחומר הלבן הם מהירות וריכוז, אף כי דווחה פגיעה גם בזיכרון ובתפקודים ניהוליים ומוטוריים9,10. נוכחות פגיעות בחומר הלבן יחד עם אוטמים עלולה לנבא פגיעה קוגניטיבית חמורה יותר, ייתכן בשל ירידה ביכולת הפיצוי.
בכ-60-90 אחוז מהחולים במחלת אלצהיימר נצפתה פתולוגיה של שבץ מוח בנתיחה שלאחר המוות וייתכן שירידה קוגניטיבית, המאובחנת באופן קליני כמחלת אלצהיימר, היא למעשה תסמונת דמנטית מעורבת בשל פתולוגיה צרברווסקולרית ופתולוגית אלצהיימר.
מחלת אלצהיימר היא הפרעה כרונית ניוונית, הגורמת לפגיעה מתקדמת בזיכרון ובתפקודים קוגניטיביים. על פי התיאוריה העמילואידית, מטבוליזם בלתי מבוקר של החלבון קדם- עמילואיד-ביתא (APP) ובהמשך יצירה של סיבים וצברי עמילואיד-ביתא, מובילים לשפעול תאי גליה ולבסוף לנזק נוירונלי, הגורם לפגיעה קוגניטיבית. עמילואיד-ביתא משפעל אסטרוציטים, מיקרוגליה ומונוציטים לפעול כתאים פרו-דלקתיים. תאים אלה משחררים שטף של ציטוקינים, כולל TNF-α והאינטרלאוקינים 11IL-1, IL-.6.
קיימת עדות לכך, שאיסכמיה מגבירה ביקוע של פפטיד עמילואיד-ביתא מ-APP. עמילואיד-ביתא עלול, אם כן, להחמיר דלקת פוסט-איסכמית ולתרום להרעת הפגיעה הצרברווסקולרית ע"י שחרור מתווכי דלקת 12.
לא ידוע אם יצירת עמילואיד-ביתא מושרית על ידי איסכמיה מובילה ליצירת רבדים עמילואידיים. אולם מחקרים בעכברים, שהונדסו גנטית לפתח רבדים, מציעים, שתוצרי ביניים של עמילואיד-ביתא מסיס עלולים להיות גורם מספיק לפגיעה קוגניטיבית12.
דלקת בשיטיון וסקולרי ומחלת אלצהיימר
למרות השוני בגורמים הראשוניים לתהליכים הניווניים ולתוצאה הנוירופתולוגית במחלת אלצהיימר לעומת שיטיון וסקולרי, שני התהליכים מתחילים כנראה שרשרת דומה של יצירת ציטוקינים בתגובה לפגיעה עצבית. שחרור הציטוקינים במערכת העצבים המרכזית מגביר בשתי המחלות שינויים פתולוגיים, כמו יצירת והצטברות עמילואיד בכלי הדם, נגעים בחומר הלבן ואנגיוגנזה. מחקר Rotterdam הראה, שעלייה ברמות חלבון מגיב-(CRP) C בדם היא ספציפית לשיטיון וסקולרי13, בעוד שעלייה ברמות IL-6 מהווה מנבא לסיכון למחלת אלצהיימר.
מספר רב של מחקרים פתולוגיים וקליניים מצביעים על מעורבות גורמי דלקת בפתוגנזה של מחלת אלצהיימר. ברבדי עמילואיד-ביתא - נמצאו מולקולות פרו-דלקתיות ומיקרוגליה משופעלים. בנוסף, תרופות נוגדות דלקת הוכחו כמקטינות את הסיכוי להופעת המחלה 14,15.
במהלך הזדקנות נורמלית מתרחש במוח תהליך דלקתי מתקדם, בו מעורבים אסטרוציטים ומיקרוגליה. בשנים האחרונות דווח גם על עלייה בציטוקינים פרו-דלקתיים כמו IL-6 ,IL-8 עם ההזדקנות17,18.
דלקת ואיסכמיה של המוח
איסכמיה מוחית מעלה באופן משמעותי תגובה דלקתית על ידי רצף שינויים סיסטמיים ומטבוליים, או על ידי שינויים מקומיים של תגובות דלקת, הנקראות תגובות השלב החריף (Acute phase response). פגיעה איסכמית גורמת לנזק תאי פרנכימטי אנדוגני ומערבת גם תגובות דלקת, הכוללות חדירה והצטברות של לויקוציטים, מונוציטים/מאקרופאגים וחלבוני סרום, בשל השבירה של מחסום דם-מוח (BBB).
במהלך השלב החריף של אוטם מוחי דווחה עלייה משמעותית בציטוקינים פרו-דלקתיים והפעלה של מסלולים פרו-דלקתיים19,20. רמות הציטוקינים נמצאו במתאם עם נפח האוטם, חומרת השבץ והתוצאה הקלינית 19,20.
לסיכום, לאיסכמיה מוחית תרומה משמעותית לירידה קוגניטיבית ולשיטיון במבוגרים. גיל, פעילות דלקתית, דיכאון ופגיעות בחומר הלבן הם גורמים שעלולים להעלות את פגיעות המוח לירידה קוגניטיבית לאחר אוטם מוחי. הבנת המנגנונים המובילים להידרדרות זו, עשויה להניב אפשרויות טיפול יעילות וממוקדות יותר, שחשיבותן עולה עם העלייה בתוחלת החיים.
ד"ר עינור בן אסאייג, PhD, מנהלת מחקר שבץ מוח, מרכז רפואי תל אביב דוא"ל: einorba@tasmc.health.gov.i
(רשימת מקורות שמורה במערכת) |