מחלת ההמופיליה (בעברית: דממת) נזכרת לראשונה בתלמוד, במסכת "יבמות", שם מוזכר דיון שנערך בציפורי ובו מסופר על יולדת אשר שני בניה הקודמים דיממו למוות לאחר ביצוע ברית מילה. בשאלה האם יש למול את הבן השלישי הכריעו חכמי התלמוד כי אין למול את הילד. זאת, מאחר שקיים סיכון לחייו, לאור העובדה שבמשפחה זו יש, כנראה, מחלה תורשתית של הבנים הזכרים עם נטייה מוגברת לדימום.
המופיליה היא מחלת הדמם המולדת השכיחה ביותר ולצורך הדיון בטיפול בה יש להקדים ולהבין את הרקע הפיזיולוגי להתפתחות המערכת ההמוסטטית ביילודים. גורמי קרישה מסונתזים בעובר החל משבוע עשירי להריון ואילך. ריכוזם של חלבוני הקרישה עולה בהדרגה והוא נמוך יותר בפגים בהשוואה ליילודים בשלים ולילדים בוגרים יותר. בפגים נמוכי משקל נמצאו רמות ירודות במיוחד של גורמי קרישה וייתכן כי תופעה זו מסבירה חלקית את העלייה בשכיחות דימומים מוחיים בקבוצה ייחודית זו. ביילוד הבשל, ריכוז חלבוני הקרישה התלויים בויטמין K (II, VII, IX, X) הוא כמחצית מערכם במבוגר וגם רמות פקטורי המגע (פרקליקראין, XI, XII HMWK,) הן נמוכות. הכושר לייצר תרומבין הוא כ-50-30 אחוז בפלזמה טבורית לעומת מבוגר, אם כי ייצור התרומבין מהיר יותר ורגיש יותר לנוכחות גורם קרישה רקמתי (Tissue factor), כנראה בגלל רמות נמוכות פיזיולוגית של מעכבי קרישה.
ביילודים עם חשד להפרעות קרישה, יש לזכור כי ערכי PT, PTT, הם מאורכים פיזיולוגית, בעוד רמת פקטורי הקרישה VIII, V, XIII תקינות בדומה לערכים במבוגר ואילו רמת פקטור XI בשיעור של 40 אחוז נחשבת לרמה תקינה ביילוד. ערכי פיברינוגן יכולים להיות נמוכים עם הארכה של זמן התרומבין, עקב נוכחות פיברינוגן עוברי, ואילו רמות החלבון והמולטימרים של וון-וויליברנד דווקא מוגברות ואינן מאפשרות אבחון סוגים קלים של מחלת וון-וויליברנד בגיל הצעיר משנה.
אפידמיולוגיה
כיום ידוע כי שכיחות המופיליה A (חסר פקטור 8) היא כ-1:5,000 לידות בנים זכרים ושכיחות המופיליה B היא 1:30,000. 70-43 אחוז מהחולים המאובחנים סובלים מהמופיליה קשה. הסיכון לדמם מוחי בינקות בחולי המופיליה קשה הוא שני אחוזים עד שמונה אחוזים. במקרים שבהם עקב אבחנה טרום לידתית ידועה המופיליה ביילוד, נמנעת לידה מכשירנית כדי להפחית הסיכון לסיבוך קשה זה. מאחר שרמות פקטור VIII ביילוד זהות למבוגר, ניתן לאבחן המופיליה A קשה (קשה, פקטור VIII נמוך מאחוז אחד), בינונית (פקטור VIII - שניים עד חמישה אחוזים), או קלה (פקטור VIII - שישה אחוזים עד 30 אחוז) כבר ביילודים. בחולי המופיליה B ניתן לאבחן את החסרים הקשים כבר סמוך ללידה אולם בשל חסר הבשלות של פקטורי הקרישה התלויים בויטמין K אצל יילודים, במקרים שבהם קיים חשד להמופיליה קלה, יש לחזור על בדיקות הדם לרמת פקטור בגיל מאוחר יותר.
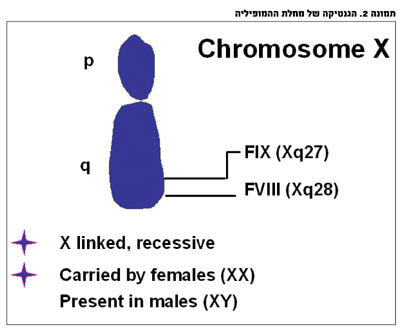
גנטיקה של מחלת ההמופיליה
הגן האחראי להמופיליה מצוי על כרומוזום X הנקבי והמחלה מועברת בתורשה רצסיבית, ולפיכך ברוב המקרים של המופיליה משפחתית נמצא בנים חולים לאמהות נשאיות. הגן של פקטור VIII ממוקם על הזרוע הארוכה של כרומוזום X (Xq28) ומכיל 26 אקסונים. מבנה הגן ייחודי והוא מועד לתקלות כגון inversion באינטרון 22. מוטציה זו אחראית לכ-40 אחוז מחולי המופיליה A בצורתה הקשה ומעלה את הסיכון להיווצרות נוגדנים לפקטור VIII תוך כדי הטיפול בחולים. מוטציות אחרות הגורמות להמופיליה A קשה כוללות: חסרים גנטיים, מוטציות נקודתיות ומוטציות מסוג Mis-sense. ככל שחומרת המוטציה קשה יותר (למשל, חסר גדול לעומת חסר קטן, מוטציה הפוגעת בקריאת ותרגום הגן לעומת מוטציה נקודתית שאינה משפיעה על מסגרת הקריאה), תוצר הגן הוא חלבון פגום יותר והסיכון ליצירת נוגדנים תוך כדי החשיפה הטיפולית לתרכיזי פקטור VIII הוא גבוה יותר.
מחסור בפקטור IX מולד אחראי לכ-25-20 אחוז ממקרי המופיליה ושכיחותו כ-1:30,000 לידות זכר. הגן של פקטור IX מכיל שמונה אקסונים וממוקם גם הוא על הזרוע הארוכה של כרומוזום X. בגן זוהו מספר רב של חסרים ומוטציות נקודתיות. בשל היכולת לבצע מניפולציות גנטיות (מאחר שמדובר בגן "קצר") התרחב בשנים האחרונות המחקר בנושא ריפוי גנטי של חולי המופיליה B. התוצאות הראשוניות מעודדות, אם כי עדיין רחוקה הדרך לריפוי מלא.
ביטויים קליניים של המופיליה
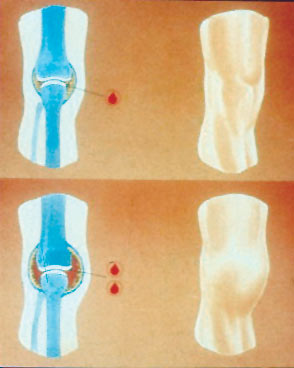
בישראל מתגלה ההמופיליה לרוב בדימום לאחר ברית מילה המלווה בהפרעת קרישה. בעולם, כשליש מהילדים ההמופילים אינם עוברים דימום משמעותי במפרקים לפני גיל שלוש שנים וההמופיליה מתגלה אצלם עקב בירור של נטייה לדמם (המטומות ואקימוזות, שמופיעות עם תחילת הזחילה וההליכה) במקרי חבלות עם דמם רב מהרגיל, בהיווצרות המטומה שרירית לאחר חיסון או במקרי דמם בבקיעת השיניים. מיעוט המקרים מתגלה כבר בלידה עקב צפלהמטומה או דמם מוחי ביילודים בשלים, המחייב בירור קרישה מעמיק. חולי המופיליה סובלים מדימומים לשרירים ולפרקים. דימום לפרק מערב בדרך כלל את רקמת החיבור, העשירה בכלי דם ("סינוביה") ומעורר תהליך דלקתי אשר בעקבותיו הופכת הרקמה לפגיעה יותר לקראת הדימום הבא. תדירות הדימומים וחומרתם תלויות בחומרת ההמופיליה (אצל חולים עם המופיליה קשה ייתכנו גם דימומים ספונטניים ולא רק לאחר טראומה, חבלה או ניתוח), אשר מושפעת בעיקר מטיב הפגם הגנטי שגרם למחלה. גנים אחרים (Modifier genes) עלולים להשפיע על ביטוי המחלה בחולים שונים, כך למשל חולים עם נטייה גנטית לקרישיות יתר ידממו פחות ויתחילו לדמם משמעותית רק בגיל מאוחר יותר, לעומת חולים הסובלים מהמופיליה באותה דרגת חומרה ובהעדר נטייה לקרישיות יתר.
תמונה 1. דימום לברך עם סינוביטיס בחולה המופילי
טיפול בהמופיליה
הטיפול המודרני בהמופיליה החל בשנת 1970 עם תחילת השימוש בתרכיזי פקטור שהופקו מדם של תורמים. הזרקות ביתיות וטיפול מוקדם הובילו לשליטה טובה יותר על הדימומים ולמניעת נזק כרוני של המחלה למפרקים. לשיטה זו היה מחיר לא קל, שכן עשר שנים מאוחר יותר התברר כי שיעור ניכר מחולי המופיליה קשה במערב אירופה ובארצות הברית נדבקו ב-HIV עקב שימוש בתרכיזי פקטור שמקורם בדם נגוע. בשנות ה-90 נמצא כי החולים הודבקו גם בוירוס הצהבת (הפטיטיס B, הפטיטיס A ובהמשך הפטיטיס C) והסתבר כי חלקם יסבול ממחלת כבד קשה שנים לאחר ההדבקה. כיום מתמקד הדיון בבטיחות פקטורי הקרישה ההומאניים כמקור פוטנציאלי להעברת וירוס הפרוו (Parvo virus), שאחראי לארתרופתיות קשות אצל החולים, או פריונים (דוגמת Jacob Creutzfeld Disease) לחולים המטופלים בתרכיזים אלה.
ב-20 השנים האחרונות הושקעו מאמצים רבים בפיתוח תרופות מטוהרות ויעילות יותר שמקורן מדם תורמים וכן פיתוח פקטורי קרישה רקומביננטיים, המיוצרים בהנדסה גנטית. מרבית הילדים הצעירים בארץ מטופלים כיום בתכשירים רקומביננטיים לפי הנחיות סל הבריאות. כמו כן פותחו תרכיזים המפעילים את מערכת הקרישה גם בחולים שבהם קיים נוגדן לפקטור קרישה - מדובר בתרכיזים ש"עוקפים" את החסר בפקטור ומקורם הומאני (למשל, שילוב פקטורים פעילים II, VII, IX, X) או רקומביננטי (פקטור VII רקומביננטי פעיל - רשום ומוכר לטיפול בחולי המופיליה עם נוגדנים במצבי דמם או ניתוח).
במקביל להתפתחויות אלו הושרש באוכלוסיית החולים נוהל לטיפול מוקדם ככל האפשר במצבי דימום ואף טיפול מונע בילדים עם דימומים חוזרים, שמטרתו להעלות את הרמה הבסיסית של פקטור הקרישה בדמם ועל ידי כך להימנע, לפחות, מדימומים ספונטניים בין ההזרקות, המבוצעות באופן סדיר מספר פעמים בשבוע.
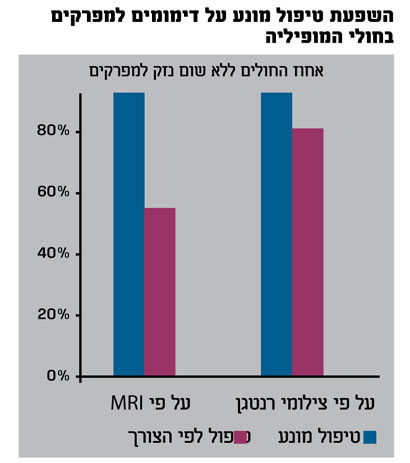
במחקר שנערך על קבוצת חולים גדולה שנבדקה במחקר פרוספקטיבי רב מרכזי בארצות הברית ופורסם לאחרונה בעיתון "ניו אינגלנד", נמצא כי מתן טיפול מונע סדיר מפחית משמעותית את תדירות הדימומים (כולל דימומים תת קליניים) ומשפר את מצב המפרקים (לפי בדיקות MRI).
שיפור הקרישה בדם נעשה על ידי שיפור התרכיזים המיוצרים בשוק וכן באמצעות עזרים המוסטטיים לטיפול מקומי ולמניעת דמם במהלך פרוצדורות כירורגיות (תחבושות קולגן, דבק ביולוגי וטיפולים אנטיפיברינוליטיים). בנוסף, השתפר גם המעקב אחרי החולים במסגרת של מרכזי המופיליה רב תחומיים המלווים את החולה בעזרה רפואית, הדרכה סיעודית ולימוד הזרקה עצמית ובמעקב משולב עם יועצים אורתופדיים, מומחים לטיפולי שיניים, יועצי מחלות זיהומיות ומחלות כבד, יועצים גנטיים, פיזיותרפיסטים, פסיכולוגים ועובדים סוציאליים - כל אלה מנסים לתת מענה לדרישות הטיפוליות הייחודיות של המחלה על הצד הטוב ביותר.
ריפוי גנטי ואבחון גנטי טרום לידתי
מאחר שמרבית המוטציות הגורמות להמופיליה ידועות, ריפוי גנטי של מחלת ההמופיליה מתאפשר על ידי נסיונות להשתיל אצל החולים גנים בריאים, שיגרמו לייצור עצמי של הפקטור החסר. בנסיונות אלה (יותר בהמופיליה B מאחר שהגן האחראי לייצור פקטור 9 קצר הרבה יותר מהגן של פקטור 8) מוזרק גן "מהונדס" בריא, הנישא על גבי וקטור ויראלי (לא פתוגני) לכבד או לפיברובלסטים של החולים כדי "להדביק" את תאי החולים בגן בריא ועל ידי כך להעלות את רמת חלבון הקרישה המיוצר בדמם. עד עתה נצפתה הצלחה לטווח קצר בלבד הן בהעלאה משמעותית והן בשימור רמת פקטור הקרישה שייצרו החולים שהשתתפו בניסויים אלה.
חשוב לציין כי גם ריפוי גנטי יעיל של המחלה עדיין אינו פותר את הבעיה הטיפולית של חולים המפתחים נוגדן לפקטור הקרישה החסר בדמם. נסיונות ראשוניים להשריית ביטוי של פקטור 8 בתוך טסיות (והעדר חשיפה שלו למערכת החיסונית ההורמורנלית) נראים מבטיחים אך מדובר במחקרים בסיסיים בלבד הנמצאים עדיין בשלב התחלתי.
במשפחות שבהן ידוע מקרה קודם של המופיליה, ניתן לאתר נשים נשאיות ולזהות בבדיקת סיסי השליה למוטציה מסוימת בגן של פקטור 8 או 9 על כרומוזום X, או בדיקת סמנים (מרקרים) ייחודיים למוטציה במשפחה, את תקינות העובר או להמליץ על הפסקת הריון בשלב מוקדם. באחרונה נעשו בארץ ובעולם נסיונות למנוע המופיליה בנשים נשאיות על ידי שימוש בהפריה חוץ גופית (IVF) וברירה גנטית של העוברים הבריאים PGD (Pregenetic determination) טרם החזרתם לרחם. תהליך (נסיוני עדיין) זה יכול למנוע לידת ילדים המופיליים גם במשפחות שמסיבות דתיות ואחרות בוחרות להימנע מהפלה של עוברים חולים ולחסוך סכומים לא מבוטלים המושקעים בהמשך הטיפול בהם על ידי מערכת הבריאות הציבורית.
לסיכום, בשנים האחרונות ההמופיליה הפכה למחלה כרונית עם פגיעה באיכות וללא פגיעה בתוחלת החיים ועם צפי לריפוי גנטי בעתיד הקרוב. עם זאת, ריפוי גנטי מוצלח עדיין לא יפתור את בעיית הנוגדנים לפקטורי קרישה שנוצרים בקרב כשליש מאוכלוסיית חולי ההמופיליה ומקשים מאוד על הטיפול היעיל בהם. בנוסף, האפשרות לברירה גנטית של עוברים בריאים עדיין איננה ריאלית עבור רוב משפחות המטופלים.
טיפול מונע יעיל בתרכיזי קרישה ובהשגחת מרכזי המופיליה יאפשר שימור של הסחוס והמפרקים וישפר משמעותית את איכות החיים של הילדים החולים כיום, תוך קיום אורח חיים רגיל ומניעה של ניתוחים אורתופדיים בעתיד.
ד"ר גילי קנת, מנהלת יחידת הקרישה, המרכז הארצי להמופיליה, שיבא, תל השומר |