הגידול הממאיר השכיח ביותר בשלד, הינוOSTEOGENIC SARCOMA (OS) והוא מאובחן בדרך כלל בקרב ילדים בעשור השני לחייהם, כאשר הם נמצאים בתקופה של גדילה מהירה ( GROWTH SPURT ). מכיוון שתקופת הגדילה המהירה נצפית מוקדם יותר אצל בנות בהשוואה לבנים, הגיל הממוצע של הופעת המחלה על פי רוב מוקדם יותר בבנות.
OS עלולה להתפתח בכל עצם במערכת השלד, אך המיקום השכיח ביותר הוא עצם הירך, בחלק הדיסטלי שלה, הסמוך למפרק הברך. החלק הקריבני של עצם הטיביה ועצם ההומרוס הקריבנית גם הם אתרים שכיחים להופעת המחלה. במרבית המקרים הופעת ה- OS הינה ספונטנית, אך קיימים גם מקרים בהם ה- OS מהווה חלק מתסמונת רחבה יותר, כגון LI-FRAUMENI SYNDROME (תסמונת ריבוי מקרי סרטן משפחתי), אשר מאופיינת בהופעת מקרי סרטן מסוג מסוים כמו סרקומה, גידולי מוח מסוג גליומה, סרטן דם מסוג ACUTE MYELOID LEUKEMIA, סרטן שד בנשים צעירות ומספר סוגי סרטן אחרים. בבסיסה של תסמונת זו נמצא פגם בגן p53, אשר לו תפקיד חשוב מאוד בבקרת חלוקת התאים. תסמונת אחרת עם סיכוי גבוה להופעת OS היא THOMPSON-ROTHMUND SYNDROME, המאופיינת בסימני הזדקנות מוקדמת (PROGERIA.OS ) מאובחנת בשכיחות גבוהה יותר גם בקרב ילדים אשר אובחנו כסובלים ממחלה ממארת אחרת - RETINOBLASTOMA, בעיקר אם ילדים אלה קבלו טיפול קרינתי. אך אף ללא טיפול קרינתי, לילדים הסובלים מ- RETINOBLASTOMA יש סיכוי גבוה לפתח בהמשך OS בגלל מוטציה ב-Rb - גן, אשר לו תפקיד חשוב מאוד בבקרת חלוקת התא ואשר מונע התמרה של תא שפיר ותקין לתא ממאיר.
תהליך האבחון
הואיל ורוב החולים סובלים מ-OS בגפיים (לרוב, הגידול ממוקם בעצמות שסביב הברך) התלונה העיקרית היא כאב מקומי וצליעה. תחילת הסימנים היא בדרך כלל הדרגתית וחלק ניכר מהילדים מתחילים לשים לב לכאב לאחר חבלה מזערית, כאשר הכאב לא חולף עם הזמן.
בבדיקה הגופנית ניתן לגלות נפיחות וכאב מקומי, המלווה ברוב המקרים בהגבלה מסוימת בתנועות המפרק המעורב. להבדיל מזיהום, בדרך כלל אין לגלות סימנים נוספים של דלקת כמו אודם וחום מקומיים.
בדיקות דם רגילות כגון ספירת דם, שקיעת דם, תפקודי כבד וכליות, לא מוסיפות מידע שעוזר לקבוע אבחנה של OS, אך לפעמים עוזרות בדיקות אלה לשלול תהליך זיהומי. צילום רגיל של חלק הגף המעורב עשוי לעזור בתהליך האבחון, וניתן באמצעותו לגלות תהליך תופס מקום באזור מטאפיזרי עם התפשטות לאורך העצם המעורבת ואל תוך הרקמות הרכות הסמוכות. הממצאים הרנטגניים מחשידים על קיומו של תהליך גידולי אצל הילד ומשלימים את הבירור על ידי בדיקת CT ו/או MRI. יתרונה של בדיקת ה-MRI הוא בכך, שהיא מאפשרת לקבוע ביתר דיוק את מידת המעורבות של הרקמות הרכות ע“י הגידול ואת מידת ההסננה של כלי הדם והעצבים המצויים בסמוך לגידול. ניתן גם להבחין באמצעות ה-MRI בצורה טובה יותר בהשוואה ל-CT במעורבות מוח עצם בעצם הנגועה. לעומת זאת, בדיקת ה- CT מאפשרת הערכה טובה יותר של פריצת קליפת העצם. בנוסף לבדיקות הדימות להערכת הגידול הראשוני, יש צורך לבצע גם בירור מערכתי. חיפוש אחרי גרורות ריאתיות נעשה באמצעות בדיקת CT של הריאות וגרורות גרמיות ניתן לזהות על ידי מיפוי עצמות סטנדרטי באמצעות Tc99m.
הטיפול
מאחר ו-OS הינה מחלה ממארת בדרגת ממאירות גבוהה, יש להתייחס אליה כאל מחלה סיסטמית אף כאשר כל בדיקות העזר שלעיל לא העידו על פיזור גרורתי. עקב כך, נהוג כיום, ללא יוצא מן הכלל, לטפל בילדים ע“י שילוב של ניתוח וכימותרפיה.
עד שנות השבעים, הטיפול היחיד לו זכו חולים עם OS היה במרבית המקרים ניתוח קטיעת הגפה. למרות שקטיעת גפה הביאה לשליטה מקומית טובה,
כ-80% מהחולים פיתחו תוך שנתיים עד שלוש שנים מהניתוח מחלה גרורתית, בעיקר בריאות, ולכן סיכויי ההישרדות ללא חזרת מחלה למשך 5 שנים לא עלו על 20%. התרופות הראשונות שהוכחו כיעילות ב-OS היו DOXORUBICIN ו- METHOTREXATE במינון גבוה. בהמשך השתלבה גם תרופה נוספת - CISPLATINUM. טיפול משולב, באמצעות משלב כימותרפיה, הכולל את שלוש התרופות הללו וניתוח, שיפר את הפרוגנוזה בצורה משמעותית. כיום, ניתן לרפא כ-70% מהילדים הללו.
קיימות כיום תרופות אחרות, נוספות, שהראו יעילות בחולי OS, כגון IFOSFAMIDE, CARBOPLATIN ו- (ETOPOSIDE (VP-16 .למרות יעילותן של תרופות אלה, התווספותן לשלוש התרופות הוותיקות יותר לא הביאה לשיפור בסיכויי ההישרדות של ילדים שלקו במחלה זו.
בנוסף, קיימת עדיין מחלוקת לגבי עיתוי מתן הטיפול הכימותרפי. בעבר, היה נהוג להתחיל בטיפול כימותרפי מיד לאחר כריתת הגידול - כימותרפיה משלימה ((ADJUVANT CHEMOTHERAPY במחשבה, שרצוי קודם כל להקטין את המסה הגידולית רק אחר כך לטפל בתאים המיקרוסקופיים המפוזרים בצורה מערכתית (סיסטמית) בכל הגוף, וזאת בהסתמך על ההשערה, שהכימותרפיה תהיה יעילה יותר אם תינתן לחולה עם TUMOR BURDEN מינימלי ככל האפשר.
כיום, רוב המרכזים בעולם מעדיפים מתן כימותרפיה הן לפני והן לאחר הניתוח (NEOADJUVANT AND ADJUVANT CHEMOTHERAPY).
הרציונל למתן כימותרפיה בצורה זו, מבוסס על שלושה עקרונות:
1. טיפול מיידי במחלה מיקרוסקופית גרורתית מערכתית.
2. הקטנה של הגידול הראשוני, אשר תאפשר לבצע ניתוח עם שוליים רחבים וחופשיים מהגידול.
3. מתן כימותרפיה לפני הניתוח מאפשר הערכת השפעתו של הטיפול על רקמת הגידול, ע“י קביעת אחוז הנמק כתוצאה ממתן הכימותרפיה הטרום ניתוחית.
כיום, מוסכם על כולם שמידת הנמק לאחר מתן טיפול כימותרפי לפני הניתוח מהווה גורם פרוגנוסטי חשוב מאוד בחולי OS.
נעשו ניסיונות לשפר את אחוזי ההישרדות של חולי OS על ידי הוספת תרופה רביעית (IFOSFOMIDE) ו/או העצמה (אינטנסיפיקציה) של הטיפול הכימותרפי, אלא שתוצאותיהם של מרבית המחקרים לא תמכו בעדיפות לתוספת שכזו.
בשנים האחרונות, רוב חולי OS בארצות הברית ובישראל טופלו לפי פרוטוקול של קבוצת האונקולוגיה של גיל הילדות - (COG) CHILDREN’S ONCOLOGY GROUP.
במחקר קליני זה חולקו כל הילדים וכל המבוגרים הצעירים שגויסו למחקר לשלוש קבוצות: קבוצה אחת קיבלה טיפול בשלוש התרופות הקלאסיות (DOXORUBICIN ,CISPLATIN ו-MTX), קבוצה שנייה טופלה ע“י ארבע תרופות (שלוש התרופות הנ“ל בתוספת IFOSFAMIDE) והמינון הכולל של DOXORUBICIN הועלה עד 600 מג/מ² (במקום 450 מג/מ²).
חולי הקבוצה השלישית קיבלו כימותרפיה במינון גבוה של IFOSFOMIDE. בנוסף, חולים בהם אחוז הנמק לא היה גבוה בצורה מספקת, קיבלו לאחר הניתוח טיפול כימותרפי משלים אינטנסיבי עוד יותר, במינונים גבוהים יותר של אותן תרופות שניתנו קודם לניתוח, או באמצעות תרופה נוספת - VP-16
התוצאות הראשוניות של מחקר זה הראו, שאין הבדל משמעותי מבחינה סטטיסטית בין הקבוצות שקיבלו טיפול כימותרפי באמצעות שלוש תרופות, לחולים שטופלו ע“י 4 תרופות. בנוסף, לא נמצאה השפעה על סיכויי ההישרדות של חולים, בהם נצפה אחוז נמק נמוך בהשפעת הכימותרפיה הקדם ניתוחית, ואשר קיבלו טיפול אינטנסיבי יותר לאחר הניתוח, בהשוואה לחולים שקבלו טיפול כימותרפי במינון רגיל, ללא אינטנסיפיקציה.
בשנים האחרונות מנסים לשלב טיפול כימותרפי קלאסי עם תרופות ביולוגיות שונות.
כך, נמצא כעת בשימוש ברוב ארצות אירופה וגם בארצות הברית הפרוטוקול הטיפולי EUROAMOS, אשר משלב כימותרפיה סטנדרטית באמצעות METHOTREXATE ,DOXORUBICIN ו- CISPLATINUM (פרוטוקול MAP) ביחד עם INTERFERON. תפקיד ה- INTERFERON בפרוטוקול זה הוא לשמש כטיפול אנטיאנגיוגנתי ואנטיפרוליפרטיבי. התוצאות של פרוטוקול זה עדיין לא פורסמו והתרומה החיובית של טיפול זה לשיפור בשיעורי ההישרדות והארכת תוחלת החיים, לא ברורה (אם בכלל קיימת).
הטיפול במחלה חוזרת
ברוב המקרים, כשמאובחנת הישנות של ,OS היא נמצאת בשלב של מחלה גרורתית, כשהריאות הן המקום השכיח ביותר לחזרת המחלה. ההישנות המקומית נצפית רק ב-5%-8% מהמקרים של הישנויות.
בכל מקרה של הישנות מקומית, יש צורך לבצע מחדש בירור גרורתי עם בדיקות הדמיה, כמו CT של בית החזה ומיפוי עצמות, כי בלא מעט מהמקרים להישנות מקומית מתלווה גם התפשטות סיסטמית של סרקומה.
כאשר מאובחנת הישנות מקומית בלבד, מבצעים בדרך כלל ניתוח חוזר (הכולל ברוב מוחלט של המקרים קטיעת גפה או חלק מהגפה).
טיפול ניתוחי הוא גם טיפול הבחירה (במידע ואפשרי מבחינה טכנית), כאשר מדובר בילדים עם הישנות סיסטמית. כיום, מקובל לבצע כריתת גרורות ריאתיות באמצעות פתיחת החזה (OPEN THORACOTOMY). בזמן האחרון, בחלק מהמרכזים הרפואיים מבצעים כריתת גרורות על ידי שיטת ASSISTED THORACOSCOPY - VIDEO. בספרות הרפואית עדיין מתנהל וויכוח האם השיטה האחרונה עדיפה על השיטה הקלאסית.
במידה וניתן לכרות את כל הגרורות הנראות ב-CT ריאות, אפשר להגיע להארכה משמעותית של תוחלת החיים בחלק ניכר מן המקרים, ואף לרפא עד 30%-40% מן הילדים האלה. פרוגנוזה אצל ילדים עם הישנות גרורתית בריאות תלויה בכמה גורמים:
מתי אובחנה הישנות (מוקדם או מאוחר). כיום מקובל לחשוב שהישנות ריאתית אשר ואבחנה 18-24 חודשים לאחר קביעת אבחנה ראשונית של OS, מהווה גורם פרוגנוסטי טוב יותר מאשר הישנות מאובחנת מוקדם יותר.
הישנות חד צדדית מקנה יותר סיכויים להבראה מהישנות בשתי הריאות.
הישנות עם גרורה בודדת עדיפה על הישנות עם מספר רב של גרורות.
עדיין לא ברור, האם הוספת טיפול כימותרפי (קו שני) משפר סיכויים להישרדות אצל חולים עם הישנות OS לאחר כריתת הגרורות. למרות חוסר וודאות בנושא זה, בחלק מהמרכזים הרפואיים בעולם נוהגים לתת טיפול כימותרפי (HIGH DOSE IFOSFAMIDE, VP-16, CARBOPLATINE )וכו‘.
טיפול קרינתי לא מאפשר השגת שליטה טובה על גידול ראשוני או על גרורות בודדות בעצמות אצל חולים עם OS, אך לפעמים יכול להיות יעיל כטיפול פליאטיבי, כאשר הגרורות גורמות לכאב ואי אפשר להוציאן בהתערבות ניתוחית (למשל גרורה בחוליה שגורמת ל-COMPRESSION SPINAL CORD).
EWING SARCOMA
(EWING SARCOMA (ES הוא גידול ממאיר של המערכת המוסקולוסקלטלית. ES שכיח פחות במקצת מ-OS. הוא שכיח ביותר בקרב ילדים בעשור השני לחייהם, אך גידול זה מאובחן הן אצל ילדים קטנים והן אצל מבוגרים עד גיל 40 שנה ואף יותר. בניגוד לגידולים מסוג SO, SE מתאפיין על ידי טרנסלוקציות כרומוזומליות ברוב מוחלט מהמקרים. הטרנסלוקציה השכיחה ביותר היא בין כרומוזומים 11, 22. כתוצאה מטרנסלוציה זו נוצר גן חדש, SWE/1ILF, אשר תפקידו, כך חושבים, הוא לקדד חלבון חדש עם תכונות של TYROSIN KINASE ועם יכולת לגרום לתא להתחלק ללא בקרה. את הטרנסלוקציה הזו אפשר לגלות בכ-95% מהמקרים של ES. מקרים נוספים מגלים טרנסלוקציות אחרות אשר מערבות גן EWS הממוקם בכרומוזום 22 ומערב גנים שונים הממוקמים בכרומוזומים 7, 2, 21. בסך הכל, טרנסלוקציות המאפיינות ES אפשר לגלות בכ-95%-98% מכל מקרי ה- ES. מבחינה מורפולוגית, תאי ES משתייכים לקבוצת גידולים ממאירים הנקראים BLUE SMALL ROUND CEL TUMORS. לאותה קבוצת גידולים שייכים גם RHABDOMYOSARCOMA, LYMPHOMA, NEUROBLASTOMA וכמה גידולים נדירים יותר כמו SMALL CELL VARIANT, INTRAABDOMINAL DESMOPLASTIC SMALL CELL TUMOR, PREDOMINTLY BLASTEMA VARIANT OF WILMS OF OS. על מנת לאבחן ES פרט לצביעות אימונוהיסטוכימיות המאפיינות ES (וימנטין, PAS ,CD99), חייב להתבצע, כנהוג, אבחון על ידי שיטות של ביולוגיה מולקולרית RT- PCR ו/או FISH. אבחון חיובי של הטרנסלוקציות הנ“ל מאפשר לקבוע לא רק אבחנה מדויקת ובהתאם לכך לקבוע גם גישה טיפולית נכונה. בדיקה זו מאפשרת גם לנבא פרוגנוזה מדויקת יותר. כיום ידוע, שהימצאות תאי ES בדם היקפי ו/או במוח עצם של חולים עם ES, מהווה גורם פרוגנוסטי חשוב עם סיכויי הישרדות לטווח ארוך קטנים בהרבה אצל חולים עם דם היקפי או מוח עצם מעורב, בהשוואה לאלה שאין להם מעורבות הזו. נהוג לחשוב שחולים עם ES עם הימצאות של תאים ממאירים בדם היקפי או במוח עצם, מתנהגים קלינית בדומה לחולים עם מחלה גרורתית מקרוסקופית, שנקבעה בעת אבחון ראשוני.
ידוע לנו, שבעת אבחון ראשוני, כ-20% מהחולים עם ES, בדומה לחולים עם OS, יימצאו כחולים עם מחלה גרורתית מיקרוסקופית, כשרוב הגרורות ממוקמות בריאות. לפעמים אפשר לאבחן מחלה גרורתית גם במקומות אחרים כמו עצמות (בכ-20% מהמקרים של מחלה גרורתית), בלוטות לימפה ובמקומות אחרים. ES יכולה גם להיות חלק מ-LI-FRAUMENI SYNDROME אך שכיחותה הרבה יותר נמוכה בהשוואה עם OS. לעתים ES יכולה להופיע גם אצל חולים שקיבלו טיפול קרינתי קודם, עקב מחלה ממארת אחרת.
תהליך האבחנה
בדומה לחולים עם OS, רוב הילדים עם ES מתלוננים על כאב מקומי ונפיחות באזור הגידול. לעיתים, חולים אלה מקשרים הופעת כאב לחבלה קטנה קודמת. חלק קטן מהילדים עם ES יסבול מחום סובפברילי, חוסר תיאבון וירידה במשקל.
בדיקה גופנית מגלה בדרך כלל נפיחות, כאב מקומי והגבלה בתנועה בגפה המעורבת. בדיקות דם רגילות כמו ספירת דם וכימיה, לא מוסיפות דבר לאבחון.
צילום רגיל ברוב המקרים הוא מאוד אינפורמטיבי ומאפשר לחשוד בכיוון של גידול ממאיר. רוב המקרים של ES מערבים דיאפיזה של עצם (בניגוד למטפיזה אצל חולים עם OS). עקב לחץ על קליפת העצם על ידי הגידול, היא מגיבה בצורה של ONION APPEARANCE SKIN הנראה בצילומי עצם פשוטים. לפעמים אפשר לראות שבר פתולוגי וסימני התפשטות של תהליך גידולי אל תוך הרקמות הרכות. למעשה, בדיקות הדמיה אשר מתבצעות אצל חולים עם חשד ל-ES לא שונות מאלה שמבצעים אצל ילדים עם חשד ל-OS. לאחר בירור גרורתי מתבצעת ביופסיה, רצוי על ידי אותו אורטופד עם ניסיון בתחום של אורטופדיה אונקולוגית, אשר בעתיד גם יבצע ניתוח דפיניטיבי (כריתת הגידול). לפעמים מתבצעת ביופסיה מחטית (CORE NEDLE BIOPSY על ידי רנטגנולוג עם בקרה של US או CT, אך הימצאות באותו זמן של אורטופד-אונקולוג חשובה ביותר, כדי לאבטח כריתת גידול עתידית עם טרקט (ROUTE) אשר נוצרת בעת הביופסיה וקרוב לוודאי מזוהמת על ידי תאי גידול. כמות החומר שמקבלים בעת ביופסיה צריכה להיות מספקת גם לביצוע צביעות רגילות וגם לביצוע בדיקות במעבדה ציטוגנתית ולביולוגיה מולקולרית.
הטיפול
הגישה הטיפולית לחולים עם ES דומה לזו של OS. מקובל לתת טיפול כימותרפי גם לפני וגם לאחר ביצוע טיפול מקומי. תרופות יעילות בחולי ES הן VINCRISTIN, DOXORUBICIN, CYTOXAN, ETOPOSIDE (VP-16) ו-IFOSFAMIDE. אלה התרופות של קו ראשון אשר נכללות בפרוטוקולים שונים העוסקים בטיפול בחולים עם ES. מקובל לאחר מספר קורסים כימותרפיים (4-6), לבצע בדיקות הדמיה חוזרות על מנת להעריך מחדש את מצבו של החולה ולעזור למנתח לתכנן ניתוח. בעת הניתוח מתבצעת כריתה שלמה של הגידול עם הכנסת תותבת פנימית. אצל ילדים אשר עדיין לא סיימו תהליך גדילה, מכניסים תותבת מוארכת (EXPANDBLE PROSTHESIS). תותבת כזו אפשר להאריך בשיטה זו או אחרת בהתאם לקצב הגדילה של הילד בעתיד, על מנת לשמור על שיוויון הגפיים. הכנסת תותבת מוארכת פחות רלבנטית אצל מתבגרים ומבוגרים צעירים אשר כבר סיימו את תהליך הגדילה. לאחר הניתוח, נמשך טיפול כימותרפי עד סיום הפרוטוקול. להבדיל מ-OS, תאי ES רגישים מאוד לקרינה ולכן במקרים בהם שוליים ניתוחים לא חופשים מתאי גידול, יש צורך להוסיף גם טיפול קרינתי כהשלמה לניתוח. בחלק מהמקרים, כאשר אין אפשרות טכנית לבצע כריתה מלאה (למשל אצל חולים עם ES בחוליות), טיפול קרינתי הוא האמצעי היחיד לבצע טיפול מקומי בחולים האלה. מנת הקרינה תלויה בגודל השארית, תוך עקרון לתת מנה כוללת של קרינה גדולה יותר במקרים עם שארית מקרוסקופית (נראית לעין) ומנה יחסית קטנה יותר במקרים עם שארית מיקרוסקופית (נראית רק במיקרוסקופ).
בשנים האחרונות, חלק ניכר של מרכזים רפואיים העוסקים בחולים עם ES, מנסים לתת טיפולים כימותרפיים שכוללים מתן תרופות במינונים מאוד גבוהים, עם החזר תאי אב שנאספו מאותו חולה מדם היקפי או מוח עצם קודם לכך. בבסיס טיפול זה נמצאת המחשבה שמתן כימותרפיה במינונים מעל המקובלים תאפשר לחסל תאים ממאירים רזידואלים, שקרוב לוודאי נשארים בגוף החולה לאחר טיפולים כימותרפיים במינון סטנדרטי וייתכן שכבר פיתחו עמידות מסוימת לתרופות, אשר ניתנו בשלבים הקודמים של הטיפול. הפרוטוקול המקובל בשנים האחרונות, שמשלב גישה קלאסית עם מתן כימותרפיה במינונים גבוהים, נקרא EUROEWING 99 והתוצאות הראשונות אשר דווחו לא מכבר בכנסים רפואיים, מאפשרות בזהירות להגיד שגישה זו יכולה להיות יעילה בחולים עם מחלה גרורתית בריאות בלבד וכנראה לא מקנה שום יתרון נוסף לחולים אחרים עם ES, בהשוואה עם טיפול סטנדרטי עם 5 התרופות שצוינו קודם.
גורמים פרוגנוסטיים:
1. מצב גרורתי בעת קביעת אבחנה ראשונית (הגורם הפרוגנוסטי החשוב ביותר).
2. אחוז הנמק של הגידול לאחר מתן טיפול כימותרפי טרום ניתוחי.
3. גודל הגידול (יותר או פחות 200 сс³). כיום ישנן טכניקות ניתוחיות, אשר מאפשרות לבצע כריתות של גידולים גדולים מאוד עם מיקום לא נוח, כמו למשל ES של אגן או של גידולים כאלה הממוקמים על יד ע“ש. לכן, חשיבות של גורם זה כמו החשיבות של מיקום הגידול, היא פחות משמעותית מבעבר.
4. כפי שצוין קודם לכן, המצאות תאים ממאירים בדם היקפי ו/או מוח עצם, מהווה גורם פרוגנוסטי חשוב מאוד גם כן.
כיום, אפשר להגיע לריפוי של חולי ES לא גרורתיים בכ-60%-70% מהמקרים.
כל החולים, אלה עם OS ואלה ES, חייבים להמשיך מעקב במרפאות אונקולוגיות למשך זמן ממושך לאחר סיום הטיפולים, על מנת לזהות ולטפל בזמן בסיבוכים לטווח ארוך. ילדים אלה סובלים ממגוון רחב של סיבוכים אורטופדיים, לבביים, אנדוקריניים (כולל בעיות פוריות) ואחרים.
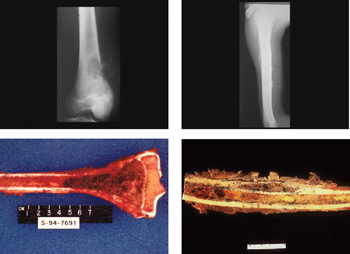
Typical rentgenologic and grossly resected appearance of OS (left) and ES (right)
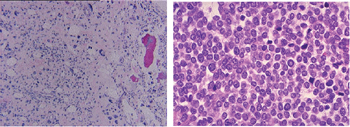
Typical pathologic pictures of OS (left) and ES (right)
 ד“ר סרגיי פוסטובסקי, אונקולוג והמטולוג ילדים, הקריה הרפואית רמב“ם, חיפה |