תחומים רבים במחלות ריאה משוועים להתקדמות טיפולית וביניהם, סרטן הריאה (מניעה, גילוי מוקדם וטיפול), מחלות זיהומיות (כגון שחפת, מניעה וכן טיפול במחלה הנגרמת על ידי חיידקים העמידים לתרופות, MDRTB), אסתמה, COPD וכן מחלות ריאה פיברוטיות אינטרסטיציליות. בכולן מתבצעת פעילות נמרצת במחקר בסיסי ויישומי, אך ברובן טרם הושגה פריצה דרך טיפולית. במאמר המובא כאן ברצוננו לתאר את תהליך שיקום חולי הריאה הלוקים ב-COPD, נדבך טיפולי חדש יחסית שחייב לשמש כמרכיב בטיפול הכולל, וכן תחומים הנוגעים למחלות נדירות (יתר לחץ דם ריאתי ו-alveolar proteinosis) המייחד תחומים אלה הן התובנות שהושגו בעיקר בעשור האחרון ואפשרו את שיפור הטיפול.
שיקום חולי ריאה
בעשור האחרון הצטברו עבודות מבוקרות רבות המורות כי תכנית שיקום לחולי ריאה עומדת בכל אמות המידה של חישובי עלות-סיכון-תועלת ו-evidence based medicine, ואלו מסוכמות בנייר העמדה של החברה האמריקאית והאירופאית למחלות ריאה1. לאור העובדה כי השתתפות בתכנית שיקום מביאה להישגים קליניים, פיזיולוגיים ופסיכולוגיים ומאפשרת שיפור בתפקוד ובאיכות החיים, יש להציע תכנית שיקום לחולים במחלות ריאה כרוניות ולא רק בשלב מתקדם של מחלתם וכמוצא אחרון, אלא להפכה לכלי זמין כבר מהשלב שבו פוגעת המחלה בתפקוד ובאיכות החיים. ההשתתפות בשיקום מחזקת את בטחונם של החולים ביכולתם לבצע פעילות גופנית וביכולתם לתפקד בחברה ובמשפחה (תמונה 2 ו-3).
תמונות 2-3: חולים ב-COPD מתאמנים בסדנת השיקום. האימון האירובי כולל הליכה על גבי מסילה נעה או באופניים. תכנית האימון מותאמת לכל משתתף על פי כושרו ומגבלותיו הייחודיים (עצימות המאמץ כשני שלישים מהמרב האישי). האימון כולל גם תרגילי נשימה וחיזוק שרירי הגפיים. החולים מתאמנים תוך תוספת חמצן לפי הצורך


הבסיס התיאורטי לשיקום ושיפור תפקוד החולים במחלות ריאה
חולים במחלות ריאה סובלים מקוצר נשימה במאמץ, סבל הפוגם בתפקוד ומכתיב אורח חיים דל בפעילות גופנית. לכאורה, הפגיעה המכאנית בריאה היא הגורמת לקושי במאמץ, אולם מתברר כי אין בחומרת מחלת הריאה כדי להסביר את חומרת המגבלה. ה-1FEV (סמן אמין של חומרת החסימה) עומד אך בהתאמה רפה לסיבולת המאמץ1. קיימים גורמים נוספים, מרכזיים ופריפריים, התורמים למגבלה ובהם: יתר לחץ ריאתי, היפוקסיה, חוסרים תזונתיים וחולשת שרירים. קיימות סיבות רבות לחולשת השריר הפריפרי וביניהן, ניוון (אטרופיה) עקב תת פעילות, חוסר תזונתי, היפוגונדיזם והשפעה קטבולית של תרופות כגון קורטיקוסטרואידים2. רעיון השיקום נסמך על ההנחה כי תיקון החוסרים הנלווים, ובעיקר שיפור תפקוד השרירים, הוא כשלעצמו לידי שיפור תפקודי, גם בלעדי שינוי בחומרת מחלת הריאה עצמה.
מכאן עולה השאלה, מהו שיקום לחולי ריאה? שיקום הוא שירות רב תחומי אשר במרכזו אימון גופני נמרץ ותמיכה קבוצתית ומטרתו לשפר את הכושר הגופני, מצב הבריאות, רמת התפקוד הפיזית, הנפשית והחברתית, הקטנת סבל ותחלואה, שיפור איכות החיים והקטנת תמותה3. דרישה מקדימה ואו לעתים מרכיב בתכנית השיקום עצמה היא טיוב (אופטימיזציה) של הטיפול הרפואי במחלת הריאה ובמחלות נלוות (כגון הפרעות שינה, חוסר תזונתי או עודף משקל).
מרכיבי תכנית השיקום
במרכז פעילות השיקום נמצא אימון אירובי של הגפיים התחתונות והעליונות (בעצימות של כשני שלישים מהמרב האישי), חיזוק שרירים ותרגילי נשימה - כל אלה בנוסף לתמיכה קבוצתית וסוציאלית והתערבות נוספת במידת הצורך בתחומים כגון הדרכה דיאטטית וסיוע בהפסקת עישון. האימון נערך בקבוצות אך תכנית האימון מותאמת אישית, נקבעת על ידי רופא העוסק בתחום ומיושמת על ידי פיזיולוג או פיזיותרפיסט הבקיאים בתורת האימון ובפיזיולוגיה של המאמץ. האימון נעשה בדרך כלל בצורה אמבולטורית, בשתיים-שלוש פגישות שבועיות, שמשך כל אחת כשעה עד שעה וחצי ומשך האימון הכולל הוא בין חודשיים לשישה חודשים.
תכנית השיקום מבוצעת בדרך כלל בצורה אמבולטורית במרפאות החוץ של המרכזים הרפואיים אך אפשר שתתבצע גם במסגרת אשפוז (בחולים הקשים) ואו אף במסגרת הקהילה (בחולים הקלים יותר שמחלתם יציבה).
מה ניתן להשיג על ידי שיקום?
השיקום מביא לידי שיפור במרבית המגבלות הקשורות למחלה. ראשית, ניתן להשיג שיפור בסיבולת המאמץ. יכולת המאמץ המרבית (על פי קליטת החמצן המרבי והסף האנאירובי וכן על פי מרחק הליכה בשש דקות) משתפרת בכדי עשרה אחוזים ויותר. חשוב מכך, יכולת ההתמדה לאורך זמן במאמץ תת מרבי עולה בכדי 60 אחוז, ולשיפור זה משמעות ניכרת על איכות החיים משום שיש בו כדי להיטיב את יכולת ההליכה, מרכיב חיוני לאיכות חיים. מטרות נוספות לשיקול היה מזעור תחושת הדיספנאה במנוחה ובמאמץ (שיפור של 28-20 אחוז על פי סולם בורג).
שיפור איכות החיים (שיפור של כ-12 אחוז על פי שאלונים מסוג SGRQ או SF-36). הפחתת חרדה ודיכאון (שיפור ב-30-15 אחוז על פי שאלונים וסולמות מקובלים). ולבסוף שיפור התפקוד המשפחתי-סוציאלי והקטנת תדירות וצמצום משך האשפוזים בכ-40 אחוז.
יש לציין כי למרות רמזים, טרם הושגה הוכחה חד משמעית כי יש בשיקום גם כדי להאריך את ההישרדות. בנוסף, קיימות הוכחות לכך כי ככל שתכנית השיקום ממושכת יותר, ההשפעה המיטיבה גדולה וממושכת. כמשך האימון כך גם עצימותו. אימון בעצימות גבוהה יחסית (רמה המביאה לעלייה ברמת חומצת החלב בדם), התועלת שבו רבה יותר. עם חלוף הזמן ואם החולה נמנע מלהתמיד בשיקום (במסגרת עצמית או ממוסדת), השפעת השיקום דועכת, אך תועלת משמעותית נותרת, גם בהעדר רצף פעילות, גם לאחר שנה ויותר ממועד תום השיקום.
מי מתאים/מועמד לשיקום ריאות?
כאמור, אין להמתין עד שהחולה מגיע לדרגת מגבלה קיצונית. יש להציע שיקום כחלק אינטגרלי מהטיפול הרפואי הכולל בכל חולה במחלת ריאה חסימתית או אחרת, בדרגת חומרה בינונית ומעלה על פי סולם GOLD, הסובל מקושי במאמץ ו/או ממגבלה תפקודית ובעיקר כאשר המחלה פוגעת ביכולתו לעמוד במטלות הנדרשות מעיסוקו ומתפקודו המשפחתי.
חשיבות מיוחדת יש לשיקום בקרב חולי ריאה בטרם ולאחר ניתוחי חזה או השתלת איברים. מרכזים רפואיים רבים בעולם (ובישראל) לא ישקלו ביצוע פעולות אלו בחולה טרם הכנה שיקומית נמרצת. לאחרונה מצטברות הוכחות על תועלת השיקום גם באוכלוסיות נוספות, כגון אלה הלוקים בחולשת שרירים עקב מחלות מערכתיות אחרות, מחלות כליה, מחלות ריאומטיות ומחלות ממאירות.
מהי זמינות השיקום בישראל?
למרות העדות הכוללת המלמדת על העלות-תועלת החיובית, פעילים בארץ רק מספר מצומצם של מרכזי שיקום למחלות ריאה. העובדה כי השיקום טרם נכלל בסל הבריאות מעכבת את התפתחות התחום ואת השימוש בשיטה טיפולית חשובה זו. יחד עם זאת, חלה התקדמות ניכרת בנושא וכמה קופות חולים מאפשרות בפועל שיקום במסגרת השירותים הניתנים למבוטחיהן, אם כי בשלב זה השיקום מוגבל לחולים הקשים יותר. לאור הכרת חשיבות הנושא קיימת תקווה כי השיקום יוכר בקרוב במסגרת סל הבריאות.
מחלות ריאה נדירות
מחלות כלי דם של הריאה, לחץ הדם במחזור הקטן, במנוחה ובמאמץ - תפוקת הלב כולה מוזרמת דרך המחזור הקטן בלחץ נמוך. גם במאמץ עולה הלחץ במידה מזערית וזאת הודות לרזרבה הניכרת של כלי דם בריאה המתאפשרת על ידי הקטנת התנגודת, PVR, על ידי גיוס (recruitment) או הרחבת (dilatation) כלי דם. הלחץ הסיסטולי אינו עולה במנוחה וגם לא במאמץ על 40 מ"מ כספית4 (וזה ניתן למדידה בלתי פולשנית בעזרת אקו-דופלר) והלחץ הממוצע (הניתן למדידה אך בצנתור ימני) אינו עולה על 25 ו-30 מ"מ כספית, בהתאמה. בנוכחות נזק מבני, תפקודי או חסימה של כלי הדם בריאה, עולה הלחץ במחזור הקטן ושריר הלב הימני המותאם ללחץ נמוך נחשף לעומס לחץ, pressure overload, מעמסה שסופה הרחבה, כישלון ואי ספיקה של הלב הימני.
יתר לחץ דם ריאתי עורקי, ראשוני - קלסיפיקציה של יתר לחץ דם ריאתי נקבעה לאחרונה5. הצורה הראשונית של המחלה נדירה יחסית, שכיחותה כ-1-2x10-5 וזו מעט שכיחה יותר בקרב נשים. תאי האנדותל משגשגים בצורה בלתי מבוקרת תוך כדי קיפוח החלל ואיבוד נפח נימי הריאה. ביטויי המחלה הם קושי במאמץ, תעוקת חזה ואיבוד הכרה, syncope. תוחלת החיים הייתה עד לאחרונה מדאיגה ביותר, עם הישרדות חציונית של כ-2.8 שנים6 ולא נמצא טיפול יעיל במחלה לבד מהשתלת ריאה או לב-ריאה. בעשור האחרון חלה התקדמות מרשימה בהבנת המחלה ובטיפול, אם כי טרם נמצאה הדרך לריפויה. ההישרדות החציונית עלתה משמעותית וכנראה הוכפלה8,7.
מסלולים פרמקולוגיים וטיפוליים: אותרו לפחות שלושה מסלולים השותפים בוויסות הלחץ הריאתי ואלה מהווים בסיס לתכנון הטיפול9. שניים מן המסלולים מווסתים באופן נורמלי את הרחבת כלי הדם בריאה, המסלול הפרוסטנואידי ומסלול ה-(NO (nitric oxide. המסלול השלישי מביא להיצרות כלי דם, מסלול האנדותלין. איתור המסלולים אפשר פיתוח מגוון תכשירים, כגון פרוסטנואידים שונים (הניתנים בהזלפה לווריד, לתת עור או בשאיפה), מעכבי פוספודיאסטרז 5, PDEI5, ונוגדי אנדותלין (שני האחרונים ניתנים בדרך הפה). תכשירים אלה מקטינים את התנגודת הריאתית, מקטינים את הלחץ הריאתי, משפרים את סיבולת המאמץ ומאריכים את משך הזמן עד התרחשות פרוגרסיה. משך החיים הוארך בהשוואה לקונטרולה היסטורית, אך רק התכשיר פלולן (epoprostenol, prostacyclin) הוכח במחקר מבוקר וישיר אל מול פלצבו כמאריך חיים10. לחולים בדרגה תפקודית קשה, ניתן להתחיל בטיפול גם בתכשירים דרך הפה. בחולים בדרגה תפקודית מתקדמת ביותר, מעניקים בדרך כלל טיפול בפרוסטנואיד (בדרך כלל פלולן), דרך צנתר מרכזי.
במקרים שבהם ההשפעה הטיפולית אינה מספקת או דועכת, ניתן להמיר או להוסיף תכשיר9. לצירוף תכשירים יש לעתים השפעה אדיטיבית. מרבית התכשירים ושילוביהם מאושרים ונכללים בסל הבריאות בישראל. מטרת הטיפול היא להשיג שיפור משמעותי בדרגה התפקודית ובסיבולת המאמץ, כמשתקף ממרחק ההליכה במשך שש דקות. בנוכחות דרגה תפקודית נמוכה ובהעדר תגובה לטיפול מיטבי משולב, יש לשקול השתלת ריאה. לאור מורכבות האבחנה והטיפול, יש הצדקה כי חולים אלה יטופלו במרכזים ייעודיים אשר רכשו ניסיון בטיפול במחלה.
לאחרונה התגלו סטיות במספר גנים ספציפיים הקשורים ליל"ד ריאתי, משפחתי או ספורדי, והעיקרית שבהן היא מוטציה בגורם הגדילה 211BMPR. טרם הובהר כיצד גורמת המוטציה למחלה ומדוע רק שיעור קטן מקרב נושאי המוטציה מפתחים מחלה קלינית.
מסלול אבחנתי בנוכחות יל"ד ריאתי: נוכחות יתר לחץ דם ריאתי מאותרת בדרך כלל לראשונה בעזרת אקו-דופלר המבוצע לבירור סימפטומים מחשידים או מסיבות אחרות. מדידה זו אמינה יחסית, אם כי לוקה באבחון שגוי שלילי וחיובי ולכן, במקרים הגבוליים אמינות מדידת הלחץ באקו מוגבלת. עם הוכחת קיום לחץ סיסטולי מוגבר, > 40 מ"מ כספית, יש לאתר גורמי סיכון כגון סיפור משפחתי או חשיפה למדכאי תיאבון. לאחר זאת יש לשלול קיום גורמים ליל"ד ריאתי משני. יש לשלול קיום מחלת ריאה על ידי בדיקת תפקודי ריאה (ו/או הדמיה). מחלת הלב השמאלי, מחלת מסתמי הלב או מום לב מולד נשללים על ידי בדיקת אקוקרדיוגרפיה ונוכחות קרישי דם בריאה נשללת על ידי מיפוי פרפוזיה ו/או על ידי CT angio של הריאה. חשוב להדגיש כי נוכחות מחלת לב או ריאה בחומרה זעירה, אין בה כדי לזקוף את הלחץ הריאתי המוגבר למחלת הלב או הריאה, ולכן אין בהן כדי לשלול כי מדובר ביל"ד ריאתי עורקי ראשוני.
צנתור הלב הימני: עם תום הבירור המתואר, יש לבצע בכל מקרה צנתור הלב הימני. לצנתור מטרות רבות ובהן מדידה מדויקת של הלחץ הריאתי, מדידת לחץ הקצה של נימי הריאה, ה-PCWP (לשם שלילה סופית של קיום הפרעה ליבית דיאסטולית) ושלילת קיום אנומליה מולדת ודלף ליבי משמאל לימין. בנוסף לאלה נבדקת בצנתור התגובה החריפה למתן מרחיבי כלי דם של הריאה. רק עשרה אחוזים עד 20 אחוז מקרב הנבדקים יגיבו משמעותית לוזודילטור12. חשיבות איתורם של המגיבים כפולה: לתגובתיות חשיבות פרוגנוסטית ובנוסף קיימת משמעות לאפשרות הטיפול בנוגדי תעלות הסידן, טיפול זול לאין שיעור ביחס לחלופות.
יתר לחץ דם ריאתי כרוני טרומבואמבולי (CTEPHT) - טרומבואמבוליזם ורידי וריאתי היא מחלה שכיחה. ברצוננו להתייחס למהלך הטבעי בחלק מהלוקים בתסחיף לריאה השורדים את השלב החריף (בהעדר ו/או בנוכחות טיפול סגולי13). מירב החולים אכן מחלימים, הקרישים נספגים והלחץ במחזור הקטן נותר נורמלי. אולם, לאחרונה התברר כי ספיגת הקרישים מן הריאה אינה מלאה ובכ-40 אחוז מהשורדים ניתן לאתר שרידי קרישים שלא נספגו14, אם כי במרבית החולים הללו אין התפתחות של יל"ד ריאתי. במעקב פרוספקטיבי אשר בוצע לאחרונה ונמשך כשנתיים לאחר האירוע החריף, נמצא כי 3.8 אחוזים מהשורדים פיתחו יל"ד ריאתי קל עד בינוני במהלך המעקב14. שיעור זה גבוה הרבה יותר מהמשוער קודם למחקר זה15 ולפיו, רק עד מחצית האחוז מקרב השורדים תסחיף חריף מפתחים CTEPHT. גורמי הסיכון להתפתחות CTEPH טרם הוגדרו ורק מיעוט החולים סובלים מנטייה פרו-טרומבוטית מוכרת. מחלת ה-CPEPHT היא קשה ופרוגרסיבית ובהעדר טיפול, מרב החולים מפתחים אי ספיקה ימנית ואינם שורדים. טיפול נוגד קרישה בחולים אלה ו/או גם מסנן לווריד הנבוב התחתון, מטרתם אך למנוע הישנות. לאחרונה התפתחה חלופה טיפולית כירורגית במחלה זו. מדובר בניתוח 17,16thrombendarthrectomy.
ניתוח זה שונה מאוד מאמבולקטומיה המבוצעת לעתים בשלב החריף, משום שבמצב הכרוני הקרישים מאורגנים ועברו אינקורפורציה לדופן העורק. לכן, נדרשת דיסקציה של הקריש המאורגן לא רק מן העורק הראשי או האונתי אלא גם מהעורקים הפריפריים, לעומק ככל שניתן. לאחר הניתוח ובעקבות רה-פרפוזיה, קיים סיכון להתפתחות בצקת ריאה. אם שרדו החולים את הניתוח (תמותה של כחמישה אחוזים), צפוי הלחץ הריאתי לרדת לנורמה ותפקוד החולים משתפר במידה ניכרת. ביצוע הניתוח דורש מיומנות רבה ועל כן הוא מבוצע במספר מוגבל של מרכזים בעולם17,16. ניתן לבצעו גם במרכזים רפואיים בארץ בסיוע מומחים עולמיים המוזמנים לפי הצורך.
טיפול תרופתי ב-CTEPHT: למרות שהטיפול הנבחר והמיטבי בחולים עם CTEPHT הוא כירורגי, ניתן להציע לחלק מן החולים גם טיפול וזודילטורי ספציפי. מדובר בעיקר בחולים עם CTEPHT אשר אינם נתיחים (הן בעקבות נוכחות קרישים בכלים פריפריים או בעקבות התוויות נגד), בחולים בהם ניסיון ניתוחי כשל (לא הושגה ירידת הלחץ) או כגשר בתקופה שטרם ולאחר הניתוח. דווחה השפעה המודינמית ותפקודית חריפה בעקבות הטיפול, אך מעטים המחקרים המבוקרים בתחום (קיים מחקר מבוקר עם בוסנטן, 18Tracleer) והידע לגבי התועלת לטווח רחוק מוגבל.
Pulmonary alveolar proteinosis) PAP) מחלה אוטואימונית - מחלה זו נדירה מאוד ובארץ מוכרים כ-22 חולים בלבד, כשני שלישים מהם הם ממוצא צפון אפריקאי או עיראקי והיתר ממוצא ערבי19 (שכיחות של כ-4-3 למיליון). המחלה שכיחה בעשור שלישי-רביעי, ובארץ שיעור הגברים והנשים דומה. למחלה שני היבטים חשובים, האחד היותה ברת טיפול יעיל והאחר הוא הרקע האוטואימוני שלה. הידע העדכני נסקר לאחרונה20. מרכיביו הפוספוליפידיים של הסורפקטנט נוצרים על ידי תאי האפיתל האלבאולריים מסוג II באופן נורמלי, אך כושר הדגרדציה של החומר לקוי ועל כן הוא מצטבר בחללים האלבאולריים, בתאי אפיתל, במקרופגים ובסימפונות הקטנים. נוכחות החומר פוגעת בחילופי הגזים ובהיענות הריאה. החולה מפתח שיעול, דיספנאה במאמץ והיפוקסיה. התפתחות הסימנים הדרגתית אך מביאה בסופו של דבר למגבלה קשה עד אי ספיקה נשימתית ולכשלון החדר הימני. הסימנים בבדיקה הפיזיקלית מזעריים, קלבינג וקולות הלוואי של הנשימה (קרפיטציות) נעדרים בדרך כלל. המחלה נוטה לעתים לרמיסיה עצמונית אך שכיח יותר כי היא מתקדמת.
אבחנת PAP: המראה הרנטגני והפער בינו לבין המצב הקליני, יש בו כדי לעורר חשד לקיום המחלה. האבחנה נקבעת על ידי דגימת הריאה בביופסיה פתוחה, בביופסיה ברונכוסקופית ולעתים אף על ידי שטיפת ריאה והדגמת מקרופגים טעונים בגופים למלריים עתירי פוספוליפיד ונוכחות חומר אאוזינופילי הנצבע חיובי ב-PAS.
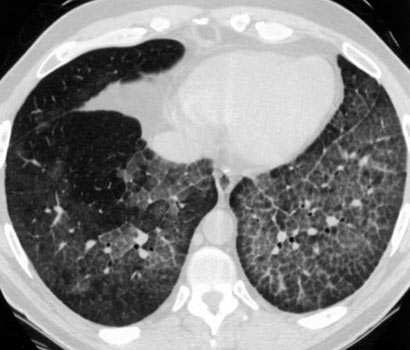
הדמיה של בית החזה ותפקודי הריאה ב-PAP: צילום בית החזה דרמטי ונראית בו עכירות/הלבנה אלבאולרית, מסיבית, דיפוסית, בכל אונות הריאה. מראה הצילום דומה לשל בצקת הריאה, אולם החולה אינו במצוקה חריפה כזו הצפויה בנוכחות בצקת או דלקת ריאה זיהומית מפושטת. כאמור, די בקיום פער זה בין מצב קליני נינוח יחסית במנוחה לבין עכירות רנטגנית מפושטת כדי לרמז על קיום המחלה. להדמיה ממוחשבת, CT, מראה אופייני וקל לזיהוי. העכירות מפושטת אך נעדרת מן הפסגות ומפריפריית הריאה כאשר הכתמים הלבנים מחורצים, בפיזור שתי וערב בקווים ספטליים מעובים היוצרים מראה אופייני כשל פתיתי שלג או אבני מדרכה (תמונה מס' 1). תפקודי הריאה מורים על קיום רסטריקציה בחומרה משתנה, היפוקסיה במנוחה הגוברת במאמץ וירידה ניכרת בכושר הדיפוסיה.
תמונה 1: מיפוי ממוחשב, CT, של בית החזה של חולה הסובל מ-PAP. ניתן להכיר בעכירות, בעיקר מסוג זכוכית מט, ground glass, המחורצת על ידי קווי רשת ספטליים היוצרים תבנית כשל פתיתי שלג. העכירות דלה יותר בפריפריה
הטיפול ב-PAP: נסיונות טיפוליים שונים ב-PAP, כולל טיפול מדכא חיסון, כשלו. הטיפול המומלץ הוא שטיפה מכאנית של הריאה לשם ריקון עודף החומר הפוספוליפידי. ביצוע השטיפה דורש צוות מיומן והיא מבוצעת בהרדמה מלאה ולאחר החדרה לקנה של צינור (Tube) מפוצל המכיל פתח אחד לסמפון השמאלי ואחר לקנה ולסמפון הימני. שני הפתחים מופרדים זה מזה בצורה מלאה כך שניתן בו זמנית להנשים ריאה אחת ולהחדיר נוזל שטיפה לאחרת. כמות הנוזל היא כ-1 ליטר בכל מחזור והוא מוזרם ומרוקן בכוח הגרביטציה ובסיוע פיזיותרפיה וויברציות. הפעולה חוזרת כעשר פעמים עד 20 פעם, ובסך הכל מוזרמים עשרה ליטרים עד 20 ליטר. ההחזר הראשוני מכיל נוזל עכור שצבעו כשל החלב והפעולה נמשכת עד אשר נוזל ההחזר הופך לצלול יחסית. לאחר מספר ימים נשטפת הריאה האחרת. לאחר השטיפה חש המטופל הקלה סימפטומטית מיידית, הנשימה "קלה" יותר, חל שיפור מיידי בחמצון ומאוחר יותר גם בתפקודי ריאה אחרים, במראה הרנטגני ובסיבולת המאמץ.
התקדמות בהבנה של האטיולוגיה של המחלה הושגה לאחרונה בדרך מקרה. במחקר המטולוגי בעכברים נמצא כי פגיעה בגורם הגדילה, GMCSF, מביא להתפתחות מחלת דמוית 20PAP. מסתבר כי גם אצל מרבית החולים ב-PAP אותרו נוגדנים עצמיים כנגד 20GMCSF. מכאן כי הבשלת המקרופגים והכשרתם לפרק את הסורפקטנט תלויה ב-GMCSF. נטרולו של ה-GMCSF על ידי הנוגדנים העצמיים פוגע בהבשלת המקרופגים. אולם למרבית הפלא, לנטרול ה-GMCSF כמעט אין השפעות נוספות, כולל מיעוט השפעות המטולוגיות, לבד מנטייה מוגברת בקרב חולים אלה לזיהומים על ידי חיידק הנוקרדיה. לאור המתואר, מחלה זו היא מודל ברור למחלה אוטואימונית באשר תפקיד הנוגדנים בהתפתחותה קריטי, כמו גם באנמיה המוליטית מסוג קומבס חיובי, מחלה הנובעת מקישור נוגדנים עצמיים לכדוריות, קישור המביא לסילוקן.
פרופ' יששכר בן-דב, מנהל המכון למחלות ריאה, המרכז הרפואי ע"ש ח. שיבא, תל השומר, מסונף לבית הספר לרפואה ע"ש סאקלר, אוניברסיטת תל אביב |