|
סיסטיק פיברוזיס, מחלה שהייתה חשוכת מרפא, עוברת מהפך טיפולי. תוחלת החיים של החולים בסיסטיק פיברוזיס (CF) משתפרת באופן מתמיד בעשורים האחרונים. חציון שנות החיים עלה מ-25 שנה בשנת 1985 ל-38 ב-12007 וילד הנולד היום עם CF צפוי לחיות עד לגיל 50 ומעלה2. קיים קשר ישיר בין אבחנה מוקדמת ביילוד ומצב תזונתי טוב יותר בשיפור בתוחלת החיים. הסיבה לכך היא המודעות הגוברת למחלה המביאה בעקבותיה לאבחון מוקדם יותר וטיפול אגרסיבי יותר בכל שלבי המחלה ובהקמתם של מרכזים המתמחים בטיפול במחלה, עם צוות רב תחומי מנוסה4,3.
עם העלייה בתוחלת החיים, קיימת מורכבות רבה יותר בטיפול הרב מערכתי של החולים. כמו כן דרושה הבנה בטיפול מותאם גיל, וזאת על מנת להפחית את מספר ימי האשפוז, מספר הטיפולים במיון ואת הצורך באנטיביוטיקה תוך ורידית.
מטרת הטיפול כיום, במקביל לשיפור בתוחלת החיים, היא לשפר את איכות החיים ולאפשר השתתפות מלאה במעגלי החיים מבחינה חברתית ואישית. הטיפול בסיסטיק פיברוזיס משמש כיום כמודל לגישה הטיפולית בילד החולה במחלה כרונית קשה, הדורשת שילוב של טיפולים מורכבים יומיומיים, אורך רוח ותקווה אצל הילד, משפחתו והצוות המטפל.
מאמר זה יעסוק בשיטות הטיפול ב-CF כיום, עדכונים בהבנת הפתוגנזה של המחלה, אבחון גנטי של נשאים וטרום לידתי ופיתוח טיפולים בפגם הבסיסי. לבסוף, אתאר את התופעה הגוברת היום של אבחון חולים עם CF לא טיפוסי, עם ספקטרום רחב של ביטויי המחלה. מומלצים מאוד לקריאה נוספת סקירה אחרונה ב-Lancet1 ו-webcast אינטראקטיבי ממרכז ג'ונס הופקינס2.
פתוגנזה של סיסטיק פיברוזיס
לחוקרים בתחום ה-CF יש כיום הבנה טובה יותר בפגם הבסיסי הנוצר בעקבות המוטציה בגן CFTR (cystic fibrosis transmembrane regulator), שבעקבותיה מתפתחות גישות חדשות לטיפול במחלה. טיפול באינהלציות מי מלח מרוכז הוא דוגמה לטיפול כזה אשר נמצא כיום בשימוש רחב. שיטות טיפול נוספות נמצאות כיום בשלבי פיתוח מתקדמים.
ב-1989 התגלתה המוטציה הנפוצה בגן המקודד את החלבון CFTR אשר גורם למחלת CF5. ביטוי הגן חשוב במיוחד בממברנה האפיקאלית של תאי אפיתל, המצפים צינורות שונים בגוף, כגון דרכי הנשימה, המעי, צינורות הלבלב האקסוקריני, הואז דפרנס המוביל זרע מהאשך, אפיתל האף והסינוסים, דרכי המרה וצינורות בלוטת הזיעה.
CFTR מתפקד בעיקר כשער למעבר יוני כלור CAMP (regulated chloride channel). עם זאת, יש לו תפקידי ויסות נוספים כגון דיכוי מעבר נתרן לתוך התא דרך epithelial sodium channel6.
עד כה תוארו יותר מ-1,500 מוטציות שונות בגן ל-CFTR אך ידועה חשיבות תפקודית של מועטות מביניהן. המוטציות הנפוצות מחולקות על פי שינוי בתפקוד החלבון לחמש קבוצות (טבלה 1) כאשר מוטציות בקבוצות I-III גורמות למחסור כמעט מוחלט ב-CFTR פעיל. לעומת זאת, מוטציות בקבוצות IV ו-V מאפשרות תפקוד חלקי של CFTR. אי ספיקת הלבלב האקסוקריני קיימת לרוב עם מוטציות בקבוצה I-III בלבד. למרות שמוטציות מקבוצה IV-V נקראות "קלות", הקשר בין הפנוטיפ לגנוטיפ חלש יותר כאשר מדובר במחלה הריאתית. נראה כי גנים אחרים (modifier genes) משפיעים על הפנוטיפ. דוגמאות לפולימורפיזם (polymorphism) בגנים אחרים הם: TGB-B1 וmannose-binding lectin-2- הקשורים למחלת ריאה קשה יותר7.
יש חולים עם מוטציות "קלות" שמגיעים להשתלת ריאות או למוות מאי ספיקה נשימתית. בנוסף ישנם אנשים בעלי מוטציות אלו אך ללא כל ביטוי קליני.
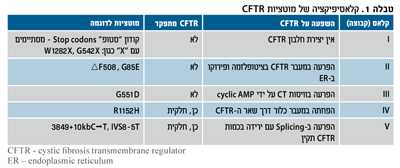
לכל עדה מוטציות נפוצות משלה. F508- (קבוצה II) היא המוטציה הנפוצה באירופה ובארצות הברית (כ-67 אחוז) אך היא קיימת רק ב-27 אחוז מהכרומוזומים בחולי CF יהודים אשכנזים8 ובאוכלוסיה זו, כ-51 אחוז מהמוטציות הן W1282X מקבוצה I (stop mutation).
סיסטיק פיברוזיס היא מחלה אוטוזמלית רצסיבית. שכיחות המחלה בקרב יהודים אשכנזים היא כ-1:3,300 חולים, בהשוואה ליהודי מרוקו שבהם שכיחות המחלה היא 1:15,000 ובקרב יהודי עיראק שבהם שכיחות המחלה היא 1:32,000 חולים9. בקרב אוכלוסיית הערבים שכיחות המחלה זהה לשכיחותה בכלל הגזע הלבן. ייתכן שקיימת השפעה על רמת שכיחות המחלה בקרב הערבים בעקבות נישואי קרובים. יש לציין שבאפריקה ובאסיה המחלה נדירה.
קיימות תיאוריות שונות לגבי הפתוגנזה של מחלת CF בעקבות הפגם ב-CFTR. היפותזת "הנפח הנמוך" גורסת כי בעקבות חוסר יציאת כלור מהתאים וחזרת יתר של נתרן, קיים מחסור ב-NaCl בחלל הצינורות ולכן גם מחסור במים. ההפרשות הצמיגות הנוצרות בעקבות זאת חוסמות את הצינורות מתחילה וגורמות להתפתחות המחלה. לדוגמה. מחסור במים בדרכי הנשימה גורם לירידה בכמות הנוזל בין הציליה ולהפחתת הפינוי המוקוציליארי. פקקי ליחה צמיגים ו"היפוקסים" במרכזם מעודדים היצמדות חיידקים ובמיוחד פסוידומונס אירוגינוזה10. בבלוטת הזיעה, ההפרעה היא הפוכה: NaCl נספג חלקית חזרה בדם ולכן הזיעה היא מלוחה.
קשר מעניין נוסף נמצא בין מוטציה ב-CFTR ותגובה דלקתית מוגזמת. בקרב תינוקות בני ארבעה שבועות נמצאה בברונכוסקופיה ולאבז', נויטרופיליה ודלקת קשה בדרכי הנשימה, אשר נמצאה עוד לפני הופעת זיהום11. קיים גירוי של מערכת NF-kappa-B בתאי אפיתל מחולי CF בתרביות תאים. קיימת הפרשה מוגזמת של ציטוקינים כמוטקטים כגון 12IL-8. כמו כן קיים חוסר שיווי משקל בין תגובה דלקתית מוגברת מאוד לבין רמה בלתי מספקת של חומרים אנדוגנים נוגדי דלקת כגון חומצות שומן (docosahexaenoic acid)13 ו-α-1anti-trypsin בדרכי האוויר.
אבחנה
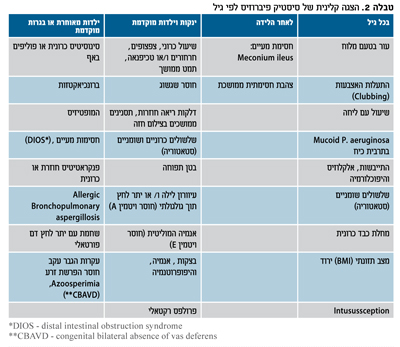
CF היא בראש ובראשונה אבחנה קלינית. למרות ההתקדמות באבחון הגנטי, איגוד ה-CF האמריקאי וקבוצה אירופאית לאבחון CF פרסמו הנחיות אשר במרכזן נמצא אחד או יותר מהתסמינים הקליניים בפנוטיפ של CF (ראו טבלה 2) ובנוסף, נדרשת הוכחה ביוכימית או גנטית להפרעה בתפקוד 14CFTR. האבחנה הביוכימית היא על ידי תבחין זיעה, בדיקה גנטית למוטציות CFTR ו/או בדיקת תפקוד CFTR ברירית האף NPD (nasal potential (difference או ברירית המעי ICM (intestinal current measurement).
אבחנה ביוכימית - מאז שנות ה-50 ועד היום, האבחנה הביוכימית הקובעת (gold standard) ב-CF נעשית על ידי תבחין הזיעה. הבדיקה זמינה, אינה יקרה ואינה פולשנית, אך עם זאת יש לבצעה בקפדנות יתרה. קיימות בדיקות סקירה מהירות בשיטת הולכה (conductance) אולם כאשר קיים חשד רציני למחלה, אבחנה דפיניטיבית חייבת בדיקה כמותית של ריכוז כלור לאחר גירוי זיעה על ידי פילוקרפין (pilocarpine iontophoresis). בדיקה זו חייבת להתבצע במרכז רפואי המבצע בדיקות רבות עם בקרת איכות קפדנית.
ניתן לבצע תבחין זיעה בפעוט מגיל מספר ימים ואין צורך להמתין עד הגיעו לגיל חודש, כפי שנהוג במרכזים שונים. יש לבצע תבחין זיעה מיד עם החשד ל-CF, כדי למנוע נזק בלתי הפיך ומצב של אי ודאות מתמשך. למרות שקיימת עלייה בריכוז הכלור התקין עם העלייה בגיל האדם, רמת כלור מעל mmol/L60 נחשבת למרמזת ל-CF בכל קבוצת גיל. יש לציין שבמקרים מסוימים, במיוחד כאשר לחולה מוטציות "קלות" המשויכות לקבוצות IV-V, התוצאה עלולה להיות גבולית,ב-60-mmol/L40 (או אפילו 60-mmol/L30 בתינוקות עד גיל שישה חודשים).
אבחנה גנטית - במקרים שבהם קיים חשד קליני ל-CF ותבחין זיעה גבולי (היום, לרוב גם בחולים עם תבחין זיעה חיובי), ניתן לבצע בדיקה גנטית למוטציות ב-CFTR. לרוב נבדקות המוטציות הנפוצות על פי השיוך לעדה. ניתן לבדוק בין שש עד כ-200 מוטציות על פי הצורך. בישראל נבדקים כ-16 מוטציות נפוצות. באוכלוסיית יהודי אשכנז ניתן לאתר כ-97 אחוז מהמוטציות על ידי בדיקת שש מוטציות נפוצות. בדיקה זאת מהווה בסיס לבדיקת "דור ישרים" המתבצעת במתבגרים בקהילה החרדית, יחד עם בדיקות גנטיות אחרות כבסיס לתכנון שידוכים15.
כיוון שיש יותר מ-1,500 מוטציות, הבדיקה הגנטית עלולה להיות false negative ואפילו genetic sequencing לא יאבחן מקרים מסוימים. במקרים אלה, בדיקת תפקוד CFTR באף (NPD) במבוגרים או בילדים מעל גיל שבע, אשר יכולים לסבול את אי נוחות הבדיקה, יכולה לעזור. בדיקה זו דורשת מיומנות רבה וקיימות מעט מעבדות המבצעות אותה. בישראל, המעבדה במרכז הרפואי הדסה, הר הצופים, נותנת מענה לחולים עם CF גבולי16. הבדיקה גם יכולה לשמש לצורכי מחקר לגבי שיפור התפקוד של חלבון ה-CFTR על ידי תרופות חדישות. לאחרונה נמצא שבדיקת CFTR במעי (ICM) נותנת מענה אבחנתי לילדים צעירים עם חשד ל-CF ותבחין זיעה גבולי וגנטיקה שלילית.
עקב מודעות גוברת של אפשרות פנוטיפים לא טיפוסיים ב-CF עם מוטציות "קלות", מאובחנים חולים אלה כילדים ועד לשנות ה-70 לחייהם. חלק מהחולים סובל רק מסינוסיטיס כרונית, עקרות הגבר או דלקת בלבלב (פנקריאטיטיס) חוזרת עם ביטוי ריאתי קל אם בכלל, וללא הפרעה בתפקוד הלבלב. במקרים אלה כדאי להשתמש במונח "מחלות הקשורות ל-CFTR" ולא סיסטיק פיברוזיס, מסיבות פרקטיות, חברתיות ופסיכולוגיות. אין ספק שהפרוגנוזה, הצורך בטיפול והתחלואה שונים לגמרי מ-CF קלאסי.
אבחנה בעת הלידה - אבחנת סיסטיק פיברוזיס המתבצעת בבדיקת סקירה של היילוד (neonatal screening) נעשית כיום באירופה, בארצות הברית ובאוסטרליה. בישראל, אין מבצעים, כיום בדיקות סקירה ל-CF ביילוד. בבדיקת ((IRT/DNA נבדקת רמת IRT (immunoreactive trypsin) בדגימת דם מהיילוד. רמה גבוהה מצביעה על פגיעה בלבלב (והיא חיובית אפילו בתינוקות עם מוטציות בקבוצות IV-V ותפקוד לבלב תקין) אם הבדיקה חיובית, מתבצעת בדיקת מוטציות CFTR נפוצות מאותה דגימת דם17.
במדינות שבהן מתבצעות בדיקות אלו, נמנע אבחון מאוחר של המחלה כאשר החולה נמצא במצב קליני קשה, עם חוסר שגשוג ומחלת ריאה מתקדמת. קיים קשר ישיר בין אבחנה מוקדמת ביילוד ומצב תזונתי טוב יותר בעתיד בשיפור בתוחלת החיים.
אבחנה טרום לידתית - אבחנה טרום לידתית ל-CF מפותחת ביותר בישראל. היום, בדיקת נשאות ל-CF נמצאת בסל הבריאות. במידה ששני ההורים הם נשאים, ניתן לבצע בדיקה טרום לידתית לעובר מסיסי שליה, או מאוחר יותר, מבדיקת דמי שפיר18. כאשר מדובר במוטציות מקבוצות I-III, צפויה מחלה מקצרת חיים. יש שאלות אתיות הקשורות להפסקת הריון, במיוחד כאשר מדובר במוטציות "קלות" יותר, כאשר הביטוי הקליני העתידי יכול להיות קל או לא קיים. במקרים אלה כדאי להמליץ על התייעצות עם רופאים המתמחים ב-CF. כאשר מוטציות מקבוצות IV-V אינן נכללות בבדיקה טרום לידתית, ילדים עם מחלת CF לא טיפוסית אך עם ביטוי ריאתי קשה יאובחנו מאוחר, לאחר נזק בלתי הפיך בריאות. במקרים אלה דרושה מודעות לאבחנה מוקדמת בקרב רופאי הילדים.
מחלת הריאה בסיסטיק פיברוזיס
מחלת הריאה בקרב חולי CF אחראית לרוב התמותה ולכן יש להתמקד בה19. מיד לאחר הלידה, אם הבדיקה מצביעה על פגיעה באם, אזי מייד מתרחש מעגל סגור של חסימה על ידי ליחה צמיגה, בדרכי האוויר, זיהום, דלקת והפרשה צמיגה עוד יותר.
בליחה ובסמוך לאפיתל מתפתח זיהום על ידי חיידקים שונים כגון סטפילוקוקוס אאוריאוס והמופילוס אינפלואנזה. בתוך זמן קצר נוסף זיהום על ידי פסוידומונס אארוגינוזה20. בתחילה, הפסוידומונס ניתן להכחדה על ידי טיפול אנטיביוטי אגרסיבי. ללא טיפול, החיידק החי בקהילות מפריש ריר מיוחד biofilm)) העוטף את קהילות החיידקים. ריר זה מגן מפני תרופות ומקרופגים ומאפשר את הנצחת הזיהום. פנוטיפ מיוחד זה, mucoid P. aeruginosa, אופייני לסיסטיק פיברוזיס21. לחולי CF אשר אינם לוקים בזיהום כרוני בפסוידומונס, תוחלת חיים טובה יותר ומצב ריאתי דלקתי מופחת. לכן, קיימות אסטרטגיות למניעת זיהום שעיקרן הפרדה בין החולים עם P. aeruginosa לבין החולים בלי פסוידומונס (cohorting). מיד עם אבחנת הזיהום, מתבצע טיפול אגרסיבי וממושך באנטיביוטיקה22.
בעקבות הזיהום בדרכי הנשימה נוצרת תגובה דלקתית עם נויטרופיליה, הפרשת ציטוקינים, אוקסידנטים ופרוטאזות. תגובה זו אינה מצליחה להתגבר על הזיהום ובנוסף לכך גורמת באופן ישיר לנזק ריאתי מתקדם. הדבר גורם ליצירת מעגל סגור של הפרשות, חסימת דרכי נשימה, זיהום ודלקת. הפרשת DNA extracellular מתאי דלקת אפופטוטים מחמירה עוד יותר את צמיגות הליחה.
עם הזמן נוצרות ברונכיאקטזות מאסיביות ("ציסטות") המלאות בהפרשה מוגלתית והפרעה אוורורית חסימתית קשה עם לכידת אוויר. לבסוף מתפתחת אי ספיקה נשימתית כרונית. לעתים עלולים להתפתח סיבוכים כגון דלף אוויר מהציסטות האפיקאליות, או המופטיזיס מאסיבית עקב עורקים ברונכיאלים קולטרלים גדולים סמוכים לדרכי האוויר.
בשנים האחרונות חולי CF מפתחים זיהומים נוספים בעייתיים, במיוחד בדרכי הנשימה. ייתכן שהטיפול האנטיביוטי הממושך ותוחלת החיים העולה משפיעים על התפתחות הזיהומים בדרכי הנשימה. החיידק Burkholderia cenocepacia עלול לגרום למחלה ריאתית פולמיננטית וקטלנית. חיידק זה מידבק במיוחד בקרב חולי CF.
זיהום ב-S. maltophilia עולה בתדירות אך אינו קשור למחלה קשה יותר. זיהום ב-nontuberculous mycobacteria נפוץ יותר מבעבר, ו-M. abcessus יכול לגרום למחלה מתקדמת על ידי חיידק יציב לרוב סוגי האנטיביוטיקה23.
כ-40 אחוז מחולי CF באוכלוסיית המבוגרים סובלים מזיהום כרוני בפטריה אספרגילוס פומיקטוס, בדרכי הנשימה. זיהום זה אינו משחק תפקיד בנזק הריאתי. בקרב אחוז אחד עד 15 אחוז מהחולים נוצרת תגובה אלרגית קשה לאספרגילוס הנקראת ABPA (allergic bronchopulmonary aspergillosis). תגובה זו מלווה בפקקי ליחה צמיגיים במיוחד בדרכי נשימה מרכזיים ((mucoid impaction הגורמים עם הזמן לברונכיאקטזות גדולות מרכזיות ולהרס ריאה מתקדם. כמו כן, התגובה מלווה ברמת
IgE>500 IU/ml, תגובה עורית מיידית לאספרגילוס, רמות IgG antibody to A. fumigatus ושינויים אופייניים בצילום חזה או CT.
הטיפול במחלת הריאה
מחקרים אפידמיולוגים מצביעים על הצלחת הגישה האגרסיבית לטיפול הנשימתי ב-CF. תפקודי הריאות גבוהים יותר אצל חולים המטופלים במרכזים שבהם הביקורות תכופות יותר, תרביות כיח מתבצעות יותר וקיים שימוש רב יותר באנטיביוטיקה דרך הפה והווריד26.
אולם, ככל שמספר התרופות והטיפולים עולים, כך תכנית הטיפול הופכת לעול כבד מבחינת זמן, כסף ושירותי מערכת הבריאות. לכן, חשוב ביותר להמליץ על טיפולים המוכחים כיעילים ובטוחים. יתר על כן, חשוב מאוד לשמור על סדר עדיפויות ולהתאים את תכנית הטיפול לחולה על סמך יכולתו המעשית לבצעה וחומרת המחלה בכל עת. מרכז ה-CF נעזר בצוות הרב תחומי כדי לשפר את היענות החולה ומשפחתו לתכנית טיפול המוסכמת.
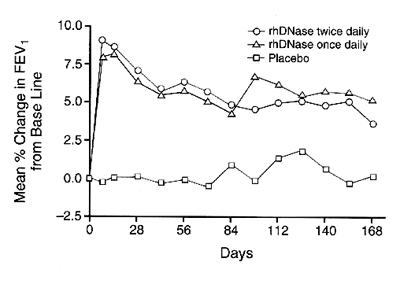
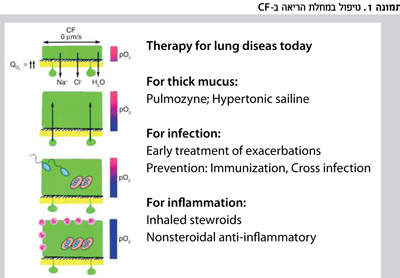
אינהלציה - קיימים טיפוליים ייחודיים אשר פותחו במיוחד למחלת הריאה ב-CF. פולמוזיים (rhDNase) באינהלציה מפרק דנ"א חוץ תאי הנמצא בריכוז גבוה בדרכי הנשימה מנויטרופילים אפופטוטים והוא מגביר את צמיגות הליחה. הטיפול גורם in vitro להורדה בצמיגות הליחה. במחקרים בחולים במשך שישה חודשים, נמצא שהטיפול הפחית התלקחויות ושיפר את תפקודי הריאות. לראשונה בהיסטוריית הטיפול ב-27CF, טיפול בטוברמיצין בתמיסה מיוחדת לאינהלציה (TOBI) פותח לחולי CF עם זיהום כרוני בפסוידומונס. במחקר שבו החולים טופלו פעמיים ביום, חודש כן וחודש לא, במשך שישה חודשים נמצא כי תפקודי הריאות השתפרו28. הצלחה דומה הוכחה בטיפול ממושך באזיתרומיצין וקיימת השערה כי מעבר להשפעה האנטיביוטית, התרופה מפחיתה את התגובה הדלקתית המוגזמת ב-29CF. לבסוף, הטיפול באינהלציות מי מלח מרוכז לראשונה מתייחסת לפגם הבסיסי ב-CF. התכשיר ההיפראוסמוטי כנראה גורם למים לצאת מתאי האפיתל לתוך האזור הפריציליארי (periciliary) ובכך משפר את הפינוי המוקוציליארי30.
על סמך מחקרים מבוקרים אלה, בעיקר בחולים מעל גיל שש, הנחיות איגוד ה-CF האמריקאי לטיפול נשימתי ב-CF ממליצות על טיפול ממושך באינהלציות פולמוזיים טוברמיצין (TOBI) (בחולים עם זיהום כרוני בפסוידומונס), מי מלח מרוכז ומרחיבי סמפונות ובאזיתרומיצין דרך הפה31. הטיפול בסטרואידים בשאיפה אינו מוכח כיעיל בקבוצה זו. בחולי CF עם שיעול כרוני וליחה, טיפולים מרובים באנטיביוטיקה דרך הפה יעילים, אך טיפול מניעתי ממושך נגד סטפילוקוק בתינוקות אסימפטומטיים מגביר את הזיהום בפסוידומונס ולכן אינו מומלץ.
הטיפול האגרסיבי בהתלקחויות ריאותיות ב-CF, במיוחד עם אנטיביוטיקה תוך ורידית, הוכח כמשפר את המצב הנשימתי ואת תוחלת החיים. אולם, לא תמיד ברור מהי התלקחות ריאתית. לרוב היא מלווה בהתגברות השיעול, שינוי בצבע ו/או כמות הליחה, ירידה בתיאבון או במשקל תוך שינוי בממצאים בהאזנה על פני הריאות32. התלקחות ריאתית מלווה כמעת תמיד בירידה בתפקודי הריאות (FEV1) ולכן מומלץ לעקוב אחרי מדד זה בכל ביקור במרפאה. בחולים עם זיהום בפסוידומונס, הטיפול המומלץ כולל שני סוגי אנטיביוטיקה דרך הווריד, עקב אפשרות של השפעה סינרגיסטית ומניעת התפתחות יציבות החיידקים. הטיפול נמשך כ-21-14 יום ויכול להתבצע באשפוז או באשפוז בית. בהתלקחויות קלות יותר הטיפול כולל quinolone כגון סיפורופלוקססין דרך הפה, ביחד עם אמינוגליקוסיד באינהלציה. כך מתאפשרת שמירה על אורך חיים רגיל מיד עם התאוששות המטופל.
פיזיותרפיה של דרכי הנשימה - ניקוז דרכי הנשימה (פיזיותרפיה) מהווה חלק מרכזי בטיפול היומיומי מיום אבחנת המחלה. בזמן התלקחויות הטיפול מוגבר אך גם כאשר המצב יציב, הטיפול הוא ממושך ויכול להימשך שעה או יותר בכל יום. במהלך הטיפול מפונה, באמצעות טכניקות שונות, הליחה הצמיגה ומנותקת מדפנות דרכי הנשימה. שיטות הטיפול כוללות נשימות דרך מכשיר PEP שונים, טכניקות נשימה באמפליטודות שונות, ויברציות לבית החזה על ידי מטפל או מכשיר. אין הרבה מחקרים מבוקרים המשווים בין השיטות וחשוב להתאים את הטיפול לחולה הספציפי ולבצע מעקב צמוד על ידי פיזיותרפיסט במרכז ה-CF. לאחרונה הופיעו הנחיות המסכמות את התחום33.
לפעילות גופנית יתרונות רבים ב-.CF היום מומלץ לבצע פעילות אירובית מגיל צעיר, מספר פעמים בשבוע. למרות שאין אפשרות להחליף את הפיזיותרפיה הנשימתית בפעילות גופנית, הפעילות עוזרת בניקוז הליחה, מפתחת שרירי נשימה, משפרת איכות חיים ומייצבת את תפקודי הריאות. ההצלחה בתחום הספורט משפרת מאוד את דימוי הגוף ואת הביטחון העצמי34.
השתלת ריאות - כאשר מופיעה אי ספיקה נשימתית כרונית, עם סטורציה של חמצן פחות מ-90 אחוז ו-FEV1 פחות מ-30 אחוז מהצפוי, חציון תוחלת החיים הוא פחות משלוש שנים. בשלב זה הברירה היחידה היא השתלת ריאות. השתלה יכולה להאריך מאוד את החיים ולשפר את איכות החיים בחולים מסוימים אך היא מלווה בסיכונים ובסיבוכים כגון זיהום ודחייה כרונית. תוחלת החיים שש שנים אחרי השתלת ריאות בחולי CF היא 50 אחוז35.
מערכת העיכול בסיסטיק פיברוזיס
מחלת לבלב ומעיים - כ-15 עד 20 אחוז מתינוקות עם CF נולדים עם חסימת מעיים על ידי מקונאום צמיג ביותר, בעיקר באזור האיליום הטרמינאלי (meconium ileus). ברוב המקרים, טיפול שמרני עם חוקנים היפראוזמוטיים (radio-opaque) תחת שיקוף ברנטגן ומתן נוזלים תוך ורידי מצליחים לעבור את השסתום האליו-צקאלי. במקרים מסוימים יש צורך בניתוח ואפילו כריתת סגמנט מהמעי הדק ויצירת אלאוסטום למספר שבועות.
כ-90 אחוז מהילדים שלהם שתי מוטציות מקבוצות I-III נולדים עם אי ספיקת הלבלב או מפתחים זאת במשך השנה הראשונה לחיים1. כתוצאה מכך מופיע שלשול שומני רב (סטאטוריה), תפיחות הבטן, חוסר שגשוג ומחסור בויטמינים מסיסי שומן (A, D, E, K). טיפול באנזימי לבלב וויטמינים מסיסי שומן משפר מאוד את המצב התזונתי של חולי CF.
בעקבות הפרשות צמיגות מדופן המעי, עדיין קיימת תופעה של חסימות מעיים ועצירות כרונית בחולי CF מבוגרים יותר. הסינדרום נקרא DIOS (distal intestinal obstruction syndrome) והתופעה קשה יותר בקרב חולים אשר אינם מתמידים בטיפול באנזימי הלבלב.
טיפול תזונתי
שמירה על מצב תזונתי טוב בחולי CF נמצאה חיונית לתוחלת חיים ארוכת טווח, FEV1 שמור ומניעת הנזק הריאתי37. הקשר ההדוק נמצא במחקרים אפידמיולוגים ובמסדי הנתונים של עשרות אלפי חולים באירופה ובארצות הברית. מעבר לטיפול קפדני באנזימי לבלב עם אי ספיקת לבלב, דרושה דיאטה רבת קלוריות ורבת שומן. הצורך בכך עולה ככל שמחלת הריאה גוברת ואיתה צריכת האנרגיה. בחלק מהחולים יש צורך בתוספות מזון כגון משקאות מיוחדים ואפילו הזנה לילית דרך גסטרוסטום. לעתים יש צורך להוסיף טיפול באומפרזול או ברניטידין כדי להוריד את רמת החומציות במערכת העיכול ולשפר את יעילות הטיפול באנזימי לבלב. מעקב צמוד של המצב התזונתי, BMI והיענות לתכנית על ידי דיאטנית מרכז ה-CF הם חלק מרכזי של כל ביקור במרפאה.
מחלת הכבד - בעקבות זרימה איטית יותר של מרה והפרעה ביחס מלחי מרה לכולסטרול, חולי CF עלולים לפתח מחלת כבד. ברוב המקרים תפקוד הכבד נשמר אך חמישה אחוזים מהחולים מפתחים שחמת ביליארית ממוקדת (focal biliary cirrhosis). אצל חלקם מופיע יתר לחץ דם פורטאלי, ספלנומגליה ודימום קשה בדליות בוושט ובקיבה. מיעוט קטן מפתח אי ספיקה כבדית ונצרך להשתלת כבד. קצב התקדמות מחלת הכבד משתנה מאוד בין חולים. בחולי CF עם הפרעה בתפקודי כבד או סימני פגיעה בכבד באולטרסאונד, טיפול באורסולית (ursodeoxycholate) עוזר38.
הפרעות בצפיפות העצם - אוסטיאופורוזיס היא משנית למחסור בויטמין D, מצב דלקתי כרוני בריאות, מצב תזונתי ירוד ושימוש חוזר בסטרואידים. אוסטיאפניה מתחילה כבר בילדות. הרס עצם גובר על בניית עצם גם בחולי CF במצב תזונתי טוב ומצב נשימתי יציב. לכן, חשוב מאוד לעקוב אחרי צפיפות העצם באופן תקופתי בחולי CF ולטפל לפי הצורך40.
סוכרת הקשורה לסיסטיק פיברוזיס CFRD (CF related diabetes) - לאחר שנים של אי ספיקת הלבלב האקסוקריני, הלבלב עובר אוטוליזה וחלק מתאי הביתא אינם מתפקדים יותר. בשלב זה, לרוב אחרי גיל עשר, חלק מחולי CF מפתחים סוכרת. כ-40 אחוז מהמתבגרים עם CF סובלים מחוסר סבילות לגלוקוז וכ-30 אחוז מהמבוגרים מעל גיל 25 שנה יסבלו מ-CFRD. רוב החולים צורכים אינסולין, אך במינונים קטנים יותר מחולי סוכרת מסוג 1. בנוסף, נדיר שחולה CF יפתח .ketoacidosis לחולי CF עם סוכרת, פרוגנוזה ריאתית פחות טובה. חשוב מאוד להקפיד על איזון טוב ולכן חשוב שהחולה יטופל על ידי מומחים לסוכרת אשר מנוסים ב-39CFRD .
מערכת הרוויה ב-CF - הואז דפרנז (vas deferens) רגיש מאוד להפרעה בתפקוד CFTR. לכן, אפילו במוטציות מקבוצות IV-V ובוודאי מקבוצות I-III, חוסר פוריות הגבר הוא תופעה נפוצה ביותר. הפתרון המצוי הוא שאיבות זרע מהאשך והזרקתו ישירות לביצית, בהפריה חוץ גופית.
נשים עם CF הן פוריות. חשוב לדאוג למצב תזונתי ונשימתי אופטימלי לפני כניסתה של אישה עם CF להריון. במצב זה, הפרוגנוזה טובה מאוד41.
טיפולי CF עתידיים
בשנים האחרונות מפותחים טיפולים ספציפיים לכל סוג של מוטציה ב-CFTR, מקבוצה I ועד V (טבלה מס' 1), ומשפרים את תפקוד הגן CFTR המוטנטי. התרופה PTC124 היא מהמתקדמות מסוג זה. המחקרים המובילים לפיתוחה, שהחלו במעבדתם של כרם ווילשנסקי עם שימוש בגנטמיצין בטיפות אף42, היו מהראשונים אשר הצליחו להראות תיקון בתפקוד ה-CFTR. בעקבות ממצאי מחקר זה, פותחה התרופה PTC124 אשר מכוונת גם היא למוטציות מקבוצה I עם premature termination codon. המוטציה הנפוצה באשכנזים, W1282X, שייכת לקבוצה זו. התרופה גורמת להמשך קריאת הגן דרך מוטציה זו וליצירת חלבון CFTR שלם43. התרופה נמצאת עתה בניסוי בפאזה III.
חלבוני CFTR עם מוטציה מקבוצה II, כגון F508, מפורקים ברטיקולום האנדופלזמטי. כיום נבדקות מולקולות קטנות כגון פנילבוטירט (phenylbutyrate) אשר מאפשרות ל-CFTR הפגום להגיע לממברנה האפיקאלית של התא. סוג תרופה זאת נקרא "מתקן" (corrector). תרופה מסוג זה עדיין לא הגיעה לניסוי קליני.
סוג תרופה המשפר את תפקוד ה-CFTR כשער כלוריד נקרא "מגביר" (potentiator) ומתאים לחולים עם מוטציות מקבוצות III או IV, בהן החלבון מגיע לממברנה האפיקאלית אך מתפקד חלקית בלבד. בחולים עם מוטציה G551D מקבוצה III (טבלה מס' 1) תרופה בשם VX-770, הנחקרת כעת (פאזה IIA), הצליחה לשפר את תפקוד ה-CFTR באף ולראשונה גם בתבחין הזיעה44.
מאז גילוי המוטציה בגן CFTR ב-1989, נעשה מאמץ רב למצוא טיפול ל-CF על ידי תיקון הגן עצמו (gene therapy). קבוצה אנגלית עובדת על ליפידים כווקטורים להעברת הגן התקין לתוך תאי האפיתל הריאתי וכך להגיע לריפוי ארוך טווח של המחלה45. עד כה טיפולים אלה הם בגדר תקווה.
לסיכום, מטרת הטיפול בחולי CF היא לשמר את תפקוד הריאה והמצב התזונתי של החולים על ידי טיפול רב מערכתי אינטנסיבי ויומיומי. חולי CF חייבים להיות מטופלים במרכזי CF המתמחים במחלה זו. הרופא אינו מסוגל לתת את הטיפול הדרוש לבדו וצוות רב תחומי מקצועי ומנוסה חייב להשתתף בטיפול. הצוות כולל אחיות, תזונאיות, פיזיותרפיסטים, עובדים סוציאליים, פסיכולוגים ואחרים המתמסרים למשימה ומלווים את החולה ומשפחתו שנים רבות. אין ספק ש-CF מהווה עדיין אתגר טיפולי רציני, עם סיפוק רב ותקווה גדולה לכל המעורבים בתחום מרתק זה.
פרופ' חנה בלאו, מנהלת מכון ריאות ומרכז סיסטיק פיברוזיס ע"ש גראוב, מרכז שניידר לרפואת ילדים בישראל, הפקולטה לרפואה ע"ש סאקלר, אוניברסיטת תל אביב |