רטיניטיס פיגמנטוזה (RP) היא למעשה משפחה של מחלות אשר כולן גורמות למחלת רשתית פרוגרסיבית ומובילות לעיוורון בלתי הפיך. משפחת מחלות זו היוותה מטרה להרבה מחקר ומאמרים בנושא, פורסמו מאות דיווחים קליניים ומעבדתיים בכל העולם, ובכולם מנסים לענות על השאלה האם ניתן לבודד את הגורם ל-RP, ואם כן, האם ניתן לטפל בו?
עם ההתפתחויות האחרונות בגנטיקה מולקולארית ובהנדסה גנטית עולים מחקרים חדשים, החושפים עוד ועוד גורמים גנטיים למחלה ומהווים קרקע פורייה לפיתוח טיפול למחלה1. ברצוננו להביא במאמר זה את החדש שנתגלה עד כה בנושא RP.
המונח רטיניטיס פיגמנטוזה הוטבע לראשונה על ידי ד"ר דונדרס בשנת 1857. זהו המינוח הפנוטיפי למספר דיסטרופיות תורשתיות, פרוגרסיביות, של הפוטורצפטורים ושל שכבת ה-RPE מתחתיה ברשתית2. האובדן הראשוני הוא של תאי ה-rod ולאחר מכן גם של תאי ה-cones.
החולה חווה בתחילה ירידה בראייה בלילה ולאחר מכן הצטמצמות של שדה הראייה ההיקפי עד לראיית צינור. אובדן של שדה הראייה המרכזי עלול לחול בשלבים הסופיים של המחלה. לרוב החולה איננו מודע לתחילתה של המחלה ומגיע לרופא העיניים בשלב מאוחר. גיל מוקדם יותר של הופעת התסמינים הוכח כגורם סיכון למחלה קשה יותר בהמשך3.
האובדן של שדה הראייה המרכזי בשלבים המאוחרים מיוחס לנגעים במקולה (מרכז הראייה ברשתית). נגעים אלה הם לרוב ניווניים (אטרופיים) ולרוב קיימים כבר מוקדם במהלך המחלה4. בחלק מהמקרים הפגיעה האטרופית במרכז הרשתית היא משנית להצטלקות של בצקת מקולארית ציסטואידית שעלולה להתרחש בשלבים מוקדמים של מחלת ה-RP.
ממצאים ב-RP
מראה הקרקעית ב-RP הוא אופייני למחלה. בשלבים הראשונים, למרות ירידה תפקודית של הפוטורצפטורים, מראה קרקעית העין עשוי בתחילת המחלה להיות תקין לחלוטין. המונח Retinitis Pigmentosa Sine Pigmento הוטבע בדיוק עבור מצב זה.
בהמשך, מופיעים השינויים הראשונים, והם כוללים היצרויות של כלי הדם העורקיים, פיגמנטציה עדינה דמוית אבק ברשתית ואובדן פיגמנט משכבת ה-RPE. ככל שמתקדמת הירידה בתפקוד הפוטורצפטורים, יש עלייה בכמות פיגמנט המלנין שמשתחרר מתאי ה-RPE המתנוונים. פיגמנט כהה זה מתחיל להיראות בהיקף הרשתית בצורה אופיינית שמכונה חודי עצם, Bone-spicules. עם הזמן, כלי הדם ברשתית ועצב הראייה מתנוונים גם הם ונראים חיוורים ודמויי שעווה. הגורם לשינויים אלה בכלי הדם איננו ברור עדיין (תמונה מס' 1).
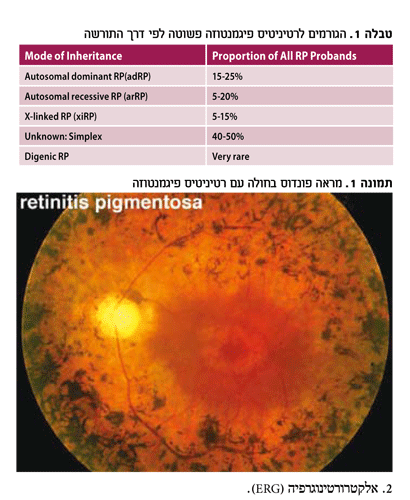
ירוד (קטרקט) תת-קופסיתי אחורי, עם שינויים צהבהבים במרכז הראייה, נפוץ בכל סוגי ה-RP. חומרת הירוד מקושרת לגיל החולה. הגורם להיווצרות הירוד איננו ידוע.
חלקיקים דמויי-אבק בזגוגית נפוצים בהרבה מחולי RP. אלה מייצגים גרגרי מלנין ריקים מתוכן, אפיתל פיגמנטרי, מונוציטים מהענבית ותאים דמויי-מקרופאגיים, אשר מפוזרים ברחבי הזגוגית. לעתים, חלקיקים אלה מופיעים טרם הופעת כתמי הפיגמנט ברשתית.
נקודות לבנות ברשתית ברמה של האפיתל הפיגמנטרי נחשבות לעדות לניוון תאי הפיגמנט ברשתית ולעתים קרויות Retinitis punctata albescens, הנחשב לסימן ל-RP.
דרוזן של עצב הראייה נפוץ בחולי RP ואין לו כל משמעות קלינית או אבחנתית.
במקרים נדירים מאוד, בחולים עם RP מתקדם, ניתן לראות דלקת של כלי הדם שמסתמנת בוסקולופתיה תפליטית, עם כלים טלאנגיאקטיטיים, אשר בהמשך עלולה להסתבך להיפרדות רשתית אקסודטיבית והנחה של ליפידים ברשתית. הסיבה להיווצרות וסקולופתיה זאת איננה ידועה.
לעתים, RP יכולה להופיע רק באזור מסוים של הרשתית ולא בכולה. צורה זו של המחלה מכונה רטיניטיס סקטוריאלית או Sector RP. כלומר, מערבת רבע או מחצית בלבד משטח קרקעית העין. הפגיעה בשדות הראייה היא פחות חמורה ובדרך כלל איננה כוללת עיוורון לילה. ידועים מעט מקרים כאלה, הן בשל השכיחות הנמוכה והן בשל התסמינים העדינים, אשר אינם מגיעים לידי אבחנה ברורה של המחלה.
על פי פרסום ועדת הקונצנזוס (מרמור ושות' 1983), האבחנה של RP נעשית על ידי5:
� ירידה בתפקוד תאי ה-Rods, כפי שנמדד ב:
1. הסתגלות לחושך (עלייה בסף הפעולה של תאי ה Rods), או:
2. אלקטרורטינוגרפיה (ERG).
� ירידה מתקדמת בתפקוד הפוטורצפטורים.
� אובדן של שדה ראייה היקפי (כפי שמודגם על פי בדיקת שדות ראייה).
� מעורבות דו עינית.
הרשתית מוערכת על ידי: (1) אופתלמוסקופיה, כולל אנגיוגרפיה עם פלורצאין; (2) הערכה תפקודית של הראייה (חדות ראייה, שדות ראייה וראיית צבעים); (3) בדיקות אלקטרופיזיולוגיות (ERG).
מחקרים חדשים על הגורמים ל-RP
השכיחות בעולם של RP היא 19-27 מתוך 100,000 איש. לא ידוע על שכיחות גבוהה יותר בגזעים או במדינות שונות, אולם בשל היות המחלה מקושרת לגנים, יש שכיחות יתר של המחלה באוכלוסיות מסוימות.
RP מסווגת לשלוש קבוצות: לא-סינדרומטית, או "פשוטה" (מערבת את מערכת הראייה בלבד); סינדרומטית (מערבת מערכות נוספות, כגון מערכת השמיעה); או סיסטמית (מערבת מספר מערכות בגוף).
עד כה זוהו יותר מ-50 מוטציות גנטיות הגורמות ל-RP, כולל: תורשה אוטוזומאלית דומיננטית (30-40 אחוז), אוטוזומאלית רצסיבית (50-60 אחוז), או X-linked (5-15 אחוז). תורשה דו-גנטית היא נדירה, אולם יכולה לקרות. מקרים עם RP הקרויה Simplex, כלומר מקרה בודד של RP בתוך משפחה, מייצגים עשרה אחוזים עד 40 אחוז ממקרי ה-RP ויכולים להיווצר ממוטציה גנטית חדשה, אשר לאחר מכן ייתכן שתועבר בתורשה של AD ,AR או XL.
פישמן ושות' גילו כי לחולי RP עם תורשה אוטוזומאלית דומיננטית יש את הפרוגנוזה הטובה ביותר. לגברים עם RP עם תורשה שהיא X-linked, יש את הפרוגנוזה הגרועה ביותר, כאשר חדות הראייה בכל הבוגרים מעל גיל 50 שנה היא נמוכה יותר מ-6/60. מטופלים עם צורה אוטוזומאלית רצסיבית או סימפלקס (מקרה בודד במשפחה) היו בינוניים מבחינת החומרה6.
במחקרים שנעשו עד כה נתגלתה המורכבות הגנטית של מחלת ה-RP. הגנים המקושרים ל-RP מקדדים חלבונים, שמעורבים בהעברת אנרגיית האור (הפוטון) לאות של תא עצבי (לתהליך העברת אנרגיית האור קוראים phototransduction), מעגל הראייה (ייצור ושחזור של כרומופורים של הרודופסין), מבנה הפוטורצפטור עצמו וגורמי ייצור של הפוטורצפטורים. אולם, רוב הגנים המקושרים ל-RP תפקידם אינו ידוע.
ה-RP קרויה בשפת הגנטיקאים מחלה הטרוגנטית, כלומר הרבה מוטציות שונות בגנים שונים גורמות לאותה המחלה. בגנים רבים שנבדקו עד כה בהקשר ל-RP, נמצאו מספר מוטציות שהן יותר שכיחות בין חולי ה-RP. למשל, מוטציות שונות בגן RHO, המקדד את הרודופסין, או מוטציות בגן RDS, המקדד peripherin.
כאשר עולה חשד ל-RP, בראש ובראשונה יש לתחקר את המטופל לגבי היסטוריה משפחתית. יש להתייחס עד לשלושה דורות אחורה, כולל גברים ונשים במשפחה. אצל נשים עם X-linked RP, המחלה היא קלה יותר מאשר בגברים במשפחה, אשר קיבלו את הגן הנ"ל מאמהותיהן.
הטיפול הקיים כיום ל-RP
טיפול בוויטמין A (15,000 יחידות בינ"ל/ ליום) גורם, כלל הנראה, להאטה מסוימת בקצב התקדמות המחלה. מטפלים בשילוב של ויטמין A עם חומצה פאלמיטית (palmitate). בשל תופעות לוואי אפשריות של מינון גבוה של ויטמין A, יש לעקוב אחרי רמות הוויטמין בדם ואחרי התפתחות הפרעה בתפקודי הכבד. יש להזהיר נשים לקראת הריון על השפעותיהן הטרטוגניות האפשריות של רמות גבוהות של ויטמין A.
במידה שמתפתחת בצקת מקולארית, נהוג לטפל בה כנהוג בבצקת מקולארית על רקע אחר. טיפול זה כולל גם טיפול בכדורי דיאמוקס. ניתוחי ירוד יכולים להועיל ולשפר במעט את איכות הראייה עבור חולים אלה. חולים אשר נותר להם מעט מאוד מהראייה המרכזית (סביב º10) דיווחו על שיפור משמעותי באיכות הראייה שלהם לאחר ניתוח ירוד.
עזרים אופטיים, כגון עדשות פילטר המסננות 97-99 אחוז מכלל הקרינה הספקטראלית והעל-סגולית, עשויים להקל על הראייה בחולי RP. עדשות אלו מפחיתות את הבוהק ואת הפיזור הפנימי של קרני האור, משפרות את הניגודיות, מפחיתות את זמן ההסתגלות למעבר בין חושך לאור ולהפך. עדשות מגדילות, כפי שמשומשות על ידי מוגבלי ראייה, יכולות גם לסייע בחלק מהמקרים.
יש לייעץ לחולי ה-RP להימנע משימוש בויטמין E, היות שזה עלול להחמיר את המחלה, בעיקר בתוספות במינונים גבוהים (400 יחידות בינ"ל/ יום)7.
טיפולים חדשים בשלבי מחקר
מבחינה של טיפולים יומיומיים פשוטים, הוכח כי תוספת יומית של לוטאין 20 מ"ג/ יום לחצי שנה גורמת לעלייה בפיגמנטציה במקולה בכ-50 אחוז מחולי ה-RP או בחולי סינדרום Usher (גירסה של RP עם חירשות). טיפול זה לא גורם לשיפור בראייה המרכזית. ההשפעה של נטילת תוסף מזון זה לאורך זמן איננה ידועה8.
ההבטחה הגדולה ביותר כיום היא הסיכוי המבצבץ לטיפול ברמה הגנטית. ההטרוגנטיות הגבוהה של RP הובילה למספר גישות לטיפול עבור קבוצה זו של מחלות. שיטות טיפול גנטי (Gene therapy) פותחו לשם תיקון של המוטציה, החלפה של הגן הפגום או דיכוי והחלפה של mRNA מוטנטי. בנוסף, נעשה מחקר בנושא קידום הישרדות וצמיחה מחדש של פוטורצפטורים על ידי הצגת גורמי צמיחה או פקטורים נוגדי מוות תאי דרך מערכות לשליחת גנים (Gene delivery systems).
מודלים של חיות מעבדה שונות למחלות של ניוון רשתית סייעו רבות בפיתוח המבחנים ראשוניים לבדיקת יעילותו של הטיפול בהחלפה גנטית. העברה של הגנים הפגומים הראתה שניתן להחיות גם מבנית וגם תפקודית את הפוטורצפטורים.
ההצלה של הפוטורצפטורים על ידי החלפת גנים הודגמה על ידי ביצוע הכלאה בין עכברים מוטנטיים לגן rho-/- (בהם הגן לרודופסין הרוס) עם דגימה גנטית מעכברים שבהם הגן תקין (rho +/+). נצפתה הבעה של הגן rho, אשר הובילה להצלה של הפוטורצפטורים ב-75 אחוז מהם, כפי שהוכח ב-ERG ובהיסטופתולוגיה של הרשתית. ניסויים טיפוליים אשר מדמים את המצב בבני אדם נעשו על ידי הזרקה תת רשתית לעכברים מוטנטיים לגן ה-RDS (המקדד חלבון, המאט את ניוון הרשתית), PDESβ, או MERTK. כל הניסויים האלה הראו הצלה משמעותית של המבנה ותפקודיות של הפוטורצפטורים.
מחקר שנעשה על ידי וולראט ושות' הראה גם הפיכה של הפגם התפקודי בתאי ה-RPE. טיפול בהחלפה גנטית, אשר הוכנס באחרונה גם לשלב הניסויים בבני אדם, הוא הניסוי בהחדרת RPE65 תקין לחולים עם דיסטרופיה גנטית ע"ש לֶבֶּר (Lebers Congenital Amaurosis, שהיא צורתה החמורה ביותר של רטינטיס פיגמנטוזה שבה העיוורון מופיע כבר בלידה או תוך שנה מהלידה). הניסוי בבני אדם היה עדיין בשלבי פיתוח, אולם דווחה הצלחה חלקית של הטיפול.
ב-RP דומיננטית, הגירסה המוטנטית של הגן גורמת להפרעה תפקודית גם של הגן המקביל התקין, או שהיא רעילה לתאים כתוצאה מהצטברות. טיפולים בצורות אלו מכוונים לקראת הריסה של ה-mRNA המוטנטי על ידי שימוש באנזימים מפרקים כגון רִיבּו-זִימִים, אשר מתוכנתים לשבירה של mRNA מוטנטי ספציפי, או על ידי siRNA אשר מדכאים mRNA מוטנטים. היות שיש למעלה ממאה מוטציות שונות ידועות, אסטרטגיה חלופית היא לדכא גם את הגן המוטנטי וגם את ה-mRNA התקין שנותר, יחד עם החלפה טוטאלית של ה-mRNA הנחוץ. אסטרטגיה זו נוצלה במחקר אחרון, שבו הצליחו לדכא mRNA מוטנטי המקדד רודופסין בעכברים ובוצעה החלפה סימולטנית של הגן הנ"ל. במחקר זה נצפתה עלייה בעובי שכבת הגרעינים החיצונית של הרשתית בעכברים המטופלים לעומת קבוצת הבקרה.
רעיון נוסף הוא שימוש בגורמי-צמיחה, על-מנת לעודד צמיחה והישרדות של פוטורצפטורים. הזרקה של פפטידים של מספר פקטורי צמיחה (כולל פקטור צמיחה של פיברובלסטים - FGF, פקטור צמיחה ציליארי - CNTF ופקטור נורוטרופי מהמוח - BDNF) לתוך חלל הזגוגית של עכברים עם ניוון רשתית, או עם גנים מוטנטים, הראתה הגנה על הפוטורצפטורים. האפקט הנוירופרוטקטיבי של CNTF הוכח במספר מודלי חיות, כולל עכבר, חולדה, כלב וחתול. בוצע מחקר שלב I, שכלל החדרת שתל תוך-עיני שבו יש תאים ברי-קופסית מודבקים עם CNTF ואשר יכולים להפריש גן זה. הבטיחות והיעילות של שתלים אלה הוכחו על ידי אדמיניסטרציה שלהם לעשרה חולים עם RP. מחקרים בעתיד יוכלו להוכיח את ההשפעה הויזואלית של שתלים אלה.
קו נוסף לטיפול הוא על ידי שימוש במשפחה של גורמים מעכבי או מונעי מוות תאי, הידועים קולקטיבית כמונעי אפופטוזיס הקשורים לכרומוזום X (XIAP). XIAP מונעים מוות תאי על ידי עיכוב גורמים, כגון קספאזות. השימוש ב-XIAP במודלי עכברים הראה הגנה של שכבות הפוטורצפטורים והתאוששות חלקית של התפקוד ב-ERG.
מחקר אחר הראה שימור של השכבה הגרעינית החיצונית ברשתית9. במחקר שבוצע על ידי יאנג ושות' נעשה שימוש בפקטור מעודד חיים המשוחרר על ידי תאי הרוד ושהוכח כשומר על החיוניות של תאי ה-cone (RdCVF). הזרקה של פקטור זה לחלל הזגוגית של עכברים מוטנטים הראתה עלייה במספר תאי ה-cone ושיפור תפקודי, כפי שהוכח על ידי ERG ועל ידי היסטופתולוגיה של הרשתית10.
מבט לעתיד
עם התפתחות הידע לגבי מיקומן של מוטציות גנטיות מסוימות והחשיבות לכמות ייצור החלבונים הקשורים אליהן, קל יותר כיום לייחס מוטציות גנטיות להתפתחות המחלה. על מנת לכסות על הפער שבין הממצאים הגנטיים לממצאים הקליניים, יש לזהות יותר גנים, זאת על ידי שימוש במחקרים משפחתיים, אך גם על ידי ניתוח טוב יותר של גנים ידועים ודרכי ניפוי טובות יותר. דרך מהירה אחת לעשות ניפוי בשליש מהחולים היא על ידי סריקה של כל המוטציות הידועות עד כה.
הבעייתיות היא בסידור מחדש גנטי (genetic rearrangement) או מחיקות גדולות, אשר ככל הנראה נפוצות יותר ממה שחושבים. יש להוסיף לשיטת הזיהוי הגנטי גם תוכנה אשר תדע לזהות שינויים אלה בנוסף למוטציות הידועות. בעייתיות נוספת בזיהוי גנטי היא של החלקים אשר אינם מתורגמים בדנ"א, כגון פרומוטרים ואינטרונים, אשר קשה מאוד לזהותם בשיטות המיפוי הגנטי הידועות כיום ואלה עלולים לכלול מידע על מוטציות נוספות הגורמות ל-RP.
לא מספיק ידוע לגבי הדרך שבה הדנ"א מתורגם, וזיהוי פגמים בייצור ה-mRNA עדיין נמצא בתחום האפור של המחקר. יש צורך בדרכים יעילות ומדויקות יותר לזיהוי שינויים בחומצות אמינו, אשר יכולים להיות קשורים להתפתחות של RP. יש לקבץ את כל המוטציות הגנטיות הידועות במבחן בודד, אשר יאפשר אבחנה, החלטה על צפי וטיפול בצורה שהיא מהירה וזולה למערכת הבריאות.
התפתחויות של טיפולים גנטיים ב-RP הראו מגמה חיובית במודלי חיות. יש עדיין מספר בעיות המקושרות לטיפול גנטי, שיש לענות עליהן:
1. מתי יש להתחיל בטיפול הגנטי - האם מוקדם במחלה, בשלב שבו עדיין יש מספיק פוטורצפטורים שניתן להצילם, או שמא בשלב מאוחר שבו כבר לחולה יש מעט להפסיד?
2. מהי דרך המתן היעילה ביותר לטיפול הגנטי - האם על ידי הזרקה ישירה או על ידי שתלים? האם לזגוגית, לתת רשתית, או אולי דרך הפה?
3. כמה מכלל שטח הרשתית צריך להיות מכוסה על ידי הטיפול הגנטי על מנת שהטיפול יוכתר כמוצלח?
4. מהו משך הטיפול הגנטי שיש לתת? כמה פעמים יש לתת אותו?
5. האם הפוטורצפטורים שיוצלו על ידי הטיפול הגנטי, יישמרו על חיותם וימשיכו לתפקד גם לאחר הפסקת הטיפול?
יש תקווה שיפותחו שיטות טכנולוגיות טובות יותר לזיהוי גנטי של המוטציות ב-RP. בשנים הקרובות, אנו צופים לראות התקדמות מדעית וארגונית ביכולת זיהוי הפגם הגנטי. יכולת זיהוי הפגם הגנטי עשויה להיות חשובה לאור ההתפתחות המהירה במחקר הטיפול הגנטי. אנו מקווים לראות התפתחות משמעותית בבחינת ההצלחה של טיפולים גנטיים בחמש עד עשר השנים הבאות וכן יישום של טיפול זה בבני אדם.
ד"ר עילית בור, מחלקת עיניים, ד"ר הדס קליש, מחלקת עיניים, היחידה לנוירו-אופתלמולוגיה, המרכז הרפואי רבין, פתח תקוה